摘要:46.(1)CH3COOHCH3COO-+H+. (2)NH4++H2ONH3·H2O+H+ (3)CH3COO-+H2OCH3COOH+OH-
网址:http://m.1010jiajiao.com/timu3_id_254492[举报]
(2013?临沭县模拟)为研究CH3COOH、HA和MOH的酸碱性的相对强弱,某兴趣小组设计了以下实验:室温下,将pH=2的两种酸溶液CH3COOH、HA和pH=12的碱MOH溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图1所示,根据所给数据,请回答下列问题:

(1)HA为
若b+c=14,则MOH为
(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)?c(OH-) D.c(OH-)/(H+)
(3)常温下,用0.10mol?L-1 NaOH溶液分别滴定20mL 0.10mol?L-1 HCl溶液和20mL 0.10 mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为
查看习题详情和答案>>

(1)HA为
强
强
酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的c(H+)大于
大于
醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).若b+c=14,则MOH为
弱
弱
碱(填“强”或“弱”).(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是
BD
BD
.A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)?c(OH-) D.c(OH-)/(H+)
(3)常温下,用0.10mol?L-1 NaOH溶液分别滴定20mL 0.10mol?L-1 HCl溶液和20mL 0.10 mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是
图3
图3
(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示)CH3COO-+H2O  CH3COOH+OH-
CH3COOH+OH-
 CH3COOH+OH-
CH3COOH+OH-CH3COO-+H2O  CH3COOH+OH-
CH3COOH+OH-
. CH3COOH+OH-
CH3COOH+OH-(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.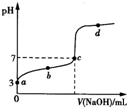 已知常温下CH3COOH的电离平衡常数为K.该温度下向20mL 0.1 mol?L-1 CH3COOH溶液中逐滴加入0.1 mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温下CH3COOH的电离平衡常数为K.该温度下向20mL 0.1 mol?L-1 CH3COOH溶液中逐滴加入0.1 mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )(1)一定条件下CH3COOH溶液中的电离平衡为:CH3COOH?CH3COO-+H+△H>0
下列方法中,可以使0.10mol?L-1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5.现有:①0.10mol?L-1CH3COOH溶液 ②0.0010mol?L-1 CH3COOH溶液
其c(H+)之比为①:②=
(3)25℃时,向0.10mol?L-1CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol?L-1,则溶液中c(H+)=
查看习题详情和答案>>
下列方法中,可以使0.10mol?L-1CH3COOH溶液中CH3COOH电离程度增大的是
bcf
bcf
.a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5.现有:①0.10mol?L-1CH3COOH溶液 ②0.0010mol?L-1 CH3COOH溶液
其c(H+)之比为①:②=
10:1
10:1
.(提示:进行简化计算,平衡时的c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同)(3)25℃时,向0.10mol?L-1CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol?L-1,则溶液中c(H+)=
1.75×10-6
1.75×10-6
mol?L-1(计算结果保留小数点后两位有效数字).溶液中各种离子浓度关系是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.(2008?佛山一模)I.图1为向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.
请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?
(2)关于该滴定实验,从下列选项中选出最恰当的一项
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
Ⅱ.t℃时,某稀硫酸溶液中c(H+)=10-a mol?L-1,c(OH-)=10-b mol?L-1,已知a+b=13:
(5)该温度下水的离子积常数Kw的数值为
(6)该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
查看习题详情和答案>>

请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?
否
否
(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB
AB
区间(若正确,此问不答).(2)关于该滴定实验,从下列选项中选出最恰当的一项
C
C
.(选填字母)
| 锥形瓶中溶液 | 滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
D
D
.A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
=
=
2c(Na+).(填“>”、“<”或“=”)Ⅱ.t℃时,某稀硫酸溶液中c(H+)=10-a mol?L-1,c(OH-)=10-b mol?L-1,已知a+b=13:
(5)该温度下水的离子积常数Kw的数值为
10-13
10-13
.(6)该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
12
12
.