摘要:在某温度下.反应H2(g)+Br2(g) 2HBr(g)达到平衡时.各物质的浓度分别是c(H2)=0.5mol/L,c(Br2)=0.1mol/L.c(HBr)=1.6mol/L.求H2.Br2.HBr可能的起始浓度. [素质优化训练]
网址:http://m.1010jiajiao.com/timu3_id_253312[举报]
将1 mol Br2(g)和2 mol H2(g)置于某2 L 密闭容器中,在一定温度下发生反应:
Br2(g)+H2(g) ![]() 2HBr(g);ΔH<0。30 s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(Ⅱ)所示。
2HBr(g);ΔH<0。30 s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(Ⅱ)所示。
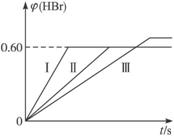
(1)达平衡时,用Br2(g)表示的化学反应速率是_____________。
(2)若改变反应条件,在甲条件下φ(HBr)的变化如图中曲线(Ⅰ)所示,在乙条件下φ(HBr)的变化如图中曲线(Ⅲ)所示,则甲条件可能是(填入下列条件的序号,下同)___________,乙条件可能是___________。
A.恒温条件下,缩小反应容器体积
B.恒温条件下,扩大反应容器体积
C.恒容条件下,升高温度
D.恒容条件下,降低温度
E.恒温、恒容条件下,加入适当催化剂
F.恒温、恒容时充入氩气
(3)若保持温度不变,在另一相同的
将固体NH4Br置于密闭容器中,在某温度下发生下列反应:NH4Br(s)  NH3(g)+HBr(g);2HBr(g)
NH3(g)+HBr(g);2HBr(g) Br2(g)+H2(g)。2 min后反应达到平衡,测得c(H2)=0.5 mol·L-1,c(HBr)=4 mol·L-1。则NH3的物质的量浓度为( )
Br2(g)+H2(g)。2 min后反应达到平衡,测得c(H2)=0.5 mol·L-1,c(HBr)=4 mol·L-1。则NH3的物质的量浓度为( )
A.3.5 mol·L-1 B.4 mol·L-1
C.4.5 mol·L-1 D.5 mol·L-1
查看习题详情和答案>>氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢方法很多.
(1)直接热分解法制氢
①属于吸热反应的是: (选填:A、B、C、D)
②某温度下,H2O(g)?H2(g)+
O2(g),平衡常数K= (用含K1、K2、K3、K4表达)
(2)热化学循环制氢
已知:Br2(g)+CaO(s)→CaBr2(s)+
O2(g)△H=-73kJ/mol
3FeBr2(s)+4H2O(g)→Fe3O4(s)+6HBr(g)+H2(g)△H=384kJ/mol
CaBr2(s)+H2O(g)→CaO(s)+2HBr(g)△H=212kJ/mol
Fe3O4(s)+8HBr(g)→Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ/mol
则H2O(g)?H2(g)+
O2(g),△H= KJ/mol
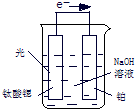
(3)光电化学分解制氢,其原理如图1.
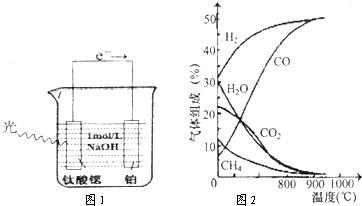
钛酸锶光电极的电极反应为4OH一+4hv-O2+2H2O,则铂电极的电极反应为 .
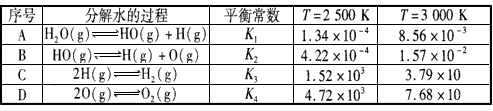
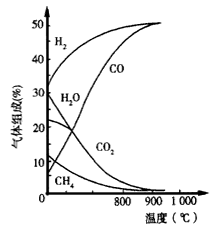
(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.0 1×105Pa下,进入转换炉,改变温度条件,各成分的体积组成关系如图2所示.下列有关图象的解读正确的是 .
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g)→CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2适宜温度约900℃
D.图象中曲线的交点处表示反应达到平衡
(5)LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式 .
查看习题详情和答案>>
(1)直接热分解法制氢
| 序号 | 分解水的过程 | 平衡常数 | T=2500K | T=3000K |
| A | H2O(g)?HO(g)+H(g) | K1 | 1.34×10-4 | 8.56×10-3 |
| B | HO(g)?H(g)+O(g) | K2 | 4.22×10-4 | 1.57×10-2 |
| C | 2H(g)?H2(g) | K3 | 1.52×103 | 3.79×10 |
| D | 2O(g)?O2(g) | K4 | 4.72×103 | 7.68×10 |
②某温度下,H2O(g)?H2(g)+
| 1 |
| 2 |
(2)热化学循环制氢
已知:Br2(g)+CaO(s)→CaBr2(s)+
| 1 |
| 2 |
3FeBr2(s)+4H2O(g)→Fe3O4(s)+6HBr(g)+H2(g)△H=384kJ/mol
CaBr2(s)+H2O(g)→CaO(s)+2HBr(g)△H=212kJ/mol
Fe3O4(s)+8HBr(g)→Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ/mol
则H2O(g)?H2(g)+
| 1 |
| 2 |
(3)光电化学分解制氢,其原理如图1.

钛酸锶光电极的电极反应为4OH一+4hv-O2+2H2O,则铂电极的电极反应为
(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.0 1×105Pa下,进入转换炉,改变温度条件,各成分的体积组成关系如图2所示.下列有关图象的解读正确的是
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g)→CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2适宜温度约900℃
D.图象中曲线的交点处表示反应达到平衡
(5)LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式
氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢方法很多。
(1)直接热分解法制氢
(1)直接热分解法制氢
①属于吸热反应的是___(选填:A、B、C、D)。
②某温度下,H2O(g)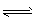 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
(2)热化学循环制氢
已知:
Br2(g)+CaO(s)=CaBr2(s) +1/2O2(g) △H= -73 kJ/mol
3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g) △H=+384 kJ/mol
CaBr2(s)+H2O(g)=CaO(s)+2HBr(g) △H=+212 kJ/mol
Fe3O4(s) +8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g) △H= -274 kJ/mol
则:H2O(g)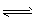 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
(3)光电化学分解制氢 光电化学分解制氢原理如图所示。钛酸锶光电极的电极反应为
4OH-+ 4hv-4e-→O2↑+2H2O,则铂电极的电极反应为___。
②某温度下,H2O(g)
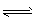 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。(2)热化学循环制氢
已知:
Br2(g)+CaO(s)=CaBr2(s) +1/2O2(g) △H= -73 kJ/mol
3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g) △H=+384 kJ/mol
CaBr2(s)+H2O(g)=CaO(s)+2HBr(g) △H=+212 kJ/mol
Fe3O4(s) +8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g) △H= -274 kJ/mol
则:H2O(g)
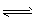 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。 (3)光电化学分解制氢 光电化学分解制氢原理如图所示。钛酸锶光电极的电极反应为
4OH-+ 4hv-4e-→O2↑+2H2O,则铂电极的电极反应为___。
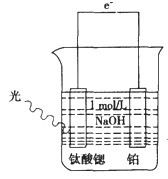
(4)生物质制氢
若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及 H2]在1. 01×105 Pa下,通入转换炉,改变温度条件,各成分的体积组成关系如图所示。下列有关图象的解读正确的是__。
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2,理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g) +H2O(g)→ CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为 900℃
D.图象中曲线的交点处表示反应达到平衡
若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及 H2]在1. 01×105 Pa下,通入转换炉,改变温度条件,各成分的体积组成关系如图所示。下列有关图象的解读正确的是__。
A.利用CH4与H2O(g)及CO2转化为合成气CO和H2,理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g) +H2O(g)→ CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为 900℃
D.图象中曲线的交点处表示反应达到平衡
(5) LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式______。
查看习题详情和答案>>
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.(1)直接热分解法制氢.某温度下,H2O(g)?H2(g)+
| 1 |
| 2 |
c(H2)c
| ||
| c(H2O) |
c(H2)c
| ||
| c(H2O) |
(2)热化学循环制氢.制备H2的反应步骤如下:
①Br2(g)+CaO(s)═CaBr2(s)+
| 1 |
| 2 |
②3FeBr2(s)+4H2O(g)═Fe3O4(s)+6HBr(g)+H2(g)△H=+384kJ?mol-1
③CaBr2(s)+H2O (g)═CaO(s)+2HBr(g)△H=+212kJ?mol-1
④Fe3O4(s)+8HBr(g)═Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ?mol-1
则 H2O(g)?H2(g)+
| 1 |
| 2 |
+249
+249
kJ?mol-1.(3)光电化学分解制氢,其原理如图.钛酸锶光电极的电极反应为4OH--4e-═O2+2H2O,则铂电极的电极反应为
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
.(4)水煤气法制氢.
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
<
<
1(填“>”、“<”或“=”).②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.(5)甲烷制氢.将1.0mol CH4和2.0mol H2O (g)通入容积为100L的反应室,在一定条件下发生反应:CH4(g)+H2O(g)═CO(g)+3H2(g).测得达到平衡所需的时间为5min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为
0.003 mol?L-1?min-1
0.003 mol?L-1?min-1
.(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质.该反应的化学方程式为
2LiBH4═2LiH+2B+3H2↑
2LiBH4═2LiH+2B+3H2↑
.