网址:http://m.1010jiajiao.com/timu3_id_253304[举报]
①H2+F2?2HF K=1047
②H2+Cl2?2HCl K=1017
③H2+Br2?2HBr K=109
④H2+I2?2HI K=1
比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是( )
|
在一定条件下,有下列分子数相同的可逆反应,其平衡常数K值分别是 ①H2+F2 ②H2+Cl2 ③H2+Br2 ④H2+I2 比较K值的大小,可知各反应的正反应进行的程度由大到小的顺序是 | |
A. |
①②③④ |
B. |
④②③① |
C. |
①④③② |
D. |
无法确定 |
①H2+F2
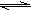 2HF K=1047
2HF K=1047②H2+Cl2
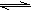 2HCl K=1017
2HCl K=1017③H2+Br2
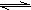 2HBr K=109
2HBr K=109④H2+I2
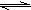 2HI K=1
2HI K=1试判断平衡时各反应的正反应进行的程度由大到小的顺序是()。
A.①②③④ B.④②③①
C.①④③② D.无法确定 查看习题详情和答案>>
在一体积为10 L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)![]() CO2(g)十H2(g) ΔH<0,且K=1.
CO2(g)十H2(g) ΔH<0,且K=1.
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
③若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“大于”“小于”或“等于”).
④CO和H2O浓度变化如下图,则0-4 min的平均反应速率v(CO)=________ mol/(L·min)
(2)若升高温度到950℃时,达到平衡时K________1(填“大于”“小于”或“等于”).

(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.

①表中3 min-4 min之间反应处于________状态;
C1数值________0.08 mol/L(填大于、小于或等于).
②反应在4 min-5 min问,平衡向逆方向移动,可能的原因是________(单选),表中5 min-6 min之间数值发生变化,可能的原因是________(单选).
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度
(4)下列叙述中说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡的是________
H2(g)+I2(g)已达到平衡的是________
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③c(HI)∶c(H2)∶c(I2)=2∶1∶1时
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
⑦条件一定,混合气体的平均相对分子质量不再变化
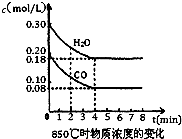 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是
(3)如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
| 1 | 2 |
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为