摘要:相同质量的镁条分别在氯气.氮气和空气中充分燃烧.所得固体产物的质量由大到小的顺序是 ,过量的镁条分别在相同状况下相同体积的氯气.氮气和空气中充分燃烧.生成的固体产物的质量由大到小的顺序是 . 分析:根据2Mg+O22MgO,3Mg+N2Mg3N2可知.当Mg为1moL时.在O2中燃烧.质量增加16克,在N2中燃烧.质量增加9.33克.相同质量的镁条在O2.N2和空气中充分燃烧生成固体物质质量由大到小的顺序是:O2>空气>N2. 当气体物质的量为1moL时.生成MgO2moL.生成Mg3N21moL.故生成固体产物的质量由大到小的顺序是:N2>空气>O2. 总结:本题考查氮气的化学性质.解答本题时.运用物质的量进行计算时可迅速作出判断,同时本题也是有关平均值的计算问题.
网址:http://m.1010jiajiao.com/timu3_id_252810[举报]
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g) 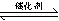 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
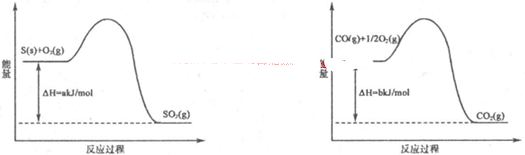
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
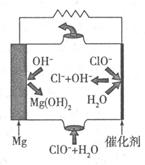
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
 查看习题详情和答案>>
查看习题详情和答案>>
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
(2)还可以用活性炭还原法处理氮氧化物,反应为:C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示

则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。

I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是: | A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示

则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
