摘要:22.某化学反应A(g)2B(g)在三种不同的条件下进行.B的起始浓度为0.反应物A的浓度随反应时间的变化情况如下表 序 号 浓度/ 时间/S mol/L 温度/K 0 20 40 60 80 100 1 T1 0.100 0.070 0.050 0.040 0.040 0.040 2 T2 c 0.086 0.063 0.051 0.051 0.051 3 T3 0.100 0.088 0.079 0.073 0.068 0.068 ①实验1中.反应在20S-40S内的平均速率V(B)为 .达到平衡时.A的转化率为 . ②实验1和2中温度相同.若均以A物质为准表示该反应的速度.则V1 V2,且 c 0.100mol/L.理由是 . ③比较实验3和1 .可推测T3 T1 .理由是 . ④做第四组实验时.在与1相同的条件下.反应起始同时投入A和B.且B的浓度为0.04mol/L.达到平衡时.又测得A.B的浓度与实验1相同.则起始时.A的浓度为 mol/L.
网址:http://m.1010jiajiao.com/timu3_id_252605[举报]
 《化学反应原理》
《化学反应原理》(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(3)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+CO(g=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
(4)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:
①700℃时,0~5min内,以B表示的平均反应速率为
②判断反应达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体中c(A)不变
C.v正(B)=2v逆(D)
D.c(A)=c(C)
③最初加入1.0mol A和2.2mol B,利用图中数据计算800℃③时的化学反应平衡常数K=
④800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06mol/L,c(B)=0.50mol/L,c(C)=0.20mol/L,c(D)=0.018mol/L,则此时该反应
 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:(1)800℃时.0-5min内,以B表示的平均反应速率为
0.24mol/(L.min)
0.24mol/(L.min)
.(2)能判断该反应达到化学平衡状态的依据是
AB
AB
.A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
0.9
0.9
,该反应为吸热
吸热
反应(填吸热或放热)(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,
n(D)=0.9mol,则此时该反应
向正反应方向
向正反应方向
进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).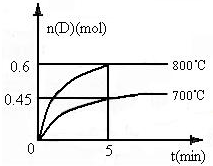 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:(1)700℃时,0-5min内,以B表示的平均反应速率为
0.18mol/(L.min)
0.18mol/(L.min)
.(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)
AB
AB
.A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c (c)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
0.9
0.9
,该反应为吸热
吸热
反应(填“吸热”或“放热”).(4)800℃时,某时刻测得体系中各物质的物质的量浓度如下:c(A)=0.06mol?L-1,c(B)=0.50mol?L-1,c(C)=0.20mol?L-1,c(D)=0.018mol?L-1,则此时该反应
向正方向进行
向正方向进行
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).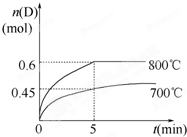 在容积为1L的密闭容器中,进行如下反应:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为
0.18mol/(L.min)
0.18mol/(L.min)
.(2)能判断反应达到化学平衡状态的依据是
ABC
ABC
.A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=
0.9
0.9
,该反应为吸热
吸热
反应(填“吸热”或“放热”).(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06mol/L,c(B)=0.50mol/L,c(C)=0.20mol/L,c(D)=0.018mol/L,则此时该反应
向正方向移动
向正方向移动
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).在容积为1L的密闭容器中,进行如下反应:
A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题: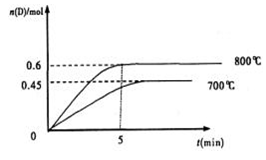
(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。