摘要:5.向aL 1mol/L的溶液中加入bg铁粉.充分反应后.溶液中和的物质的量浓度相等.此反应的离子方程式为 .a与b之比为 .
网址:http://m.1010jiajiao.com/timu3_id_252215[举报]
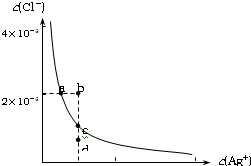 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s) Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )
查看习题详情和答案>>
25℃时0.1mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若乙的解释正确,溶液的pH应
(3)常温下将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液.判断:
①溶液中共有
②其中有两种粒子的物质的量之和一定等于0.010mol,它们是
③溶液中n(CH3COO-)+n(OH-)-n(H+)=
查看习题详情和答案>>
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中的
B
B
(填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性).A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若乙的解释正确,溶液的pH应
增大
增大
(填“增大”“减小”或“不变”).(3)常温下将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液.判断:
①溶液中共有
7
7
种粒子;②其中有两种粒子的物质的量之和一定等于0.010mol,它们是
CH3COOH
CH3COOH
和CH3COO-
CH3COO-
;③溶液中n(CH3COO-)+n(OH-)-n(H+)=
0.006
0.006
mol.(1)常温下,0.1mol/L的醋酸和0.1mol/L的盐酸各100mL,分别与足量的锌粒反应,产生的气体体积前者
(2)常温下,0.1mol/L的醋酸和pH=1的醋酸各100mL,分别与足量的锌粒反应,产生的气体前者比后者
(3)在25℃条件下将pH=3的醋酸稀释100倍,稀释后溶液的pH为(填选项字母,下同)
A.5 B.7 C.3~5之间 D.5~7之间
(4)25℃时,向0.1mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将
A.增大 B.减小 C.不变 D.无法确定
(5)常温下,向0.1mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入
A.碳酸钠晶体 B.醋酸钠晶体 C.滴加少量硫酸铜溶液 D.水
(6)常温下,将0.010mol CH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,溶液中n(CH3COO-)+n(OH-)-n(H+)=
查看习题详情和答案>>
=
=
后者(填“<”“>”或“=”).(2)常温下,0.1mol/L的醋酸和pH=1的醋酸各100mL,分别与足量的锌粒反应,产生的气体前者比后者
<
<
(填“多”或“少”).(3)在25℃条件下将pH=3的醋酸稀释100倍,稀释后溶液的pH为(填选项字母,下同)
C
C
.A.5 B.7 C.3~5之间 D.5~7之间
(4)25℃时,向0.1mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将
A
A
.A.增大 B.减小 C.不变 D.无法确定
(5)常温下,向0.1mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入
BD
BD
试剂.A.碳酸钠晶体 B.醋酸钠晶体 C.滴加少量硫酸铜溶液 D.水
(6)常温下,将0.010mol CH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,溶液中n(CH3COO-)+n(OH-)-n(H+)=
0.006
0.006
mol.硫及其化合物在生产、生活中有广泛的应用,请回答下列问题:
(1)已知S的燃烧热为297kJ?mol-1,H2S完全燃烧的热化学方程式为H2S(g)+1.5O2(g)=SO2(g)+H2O (l)△H=-586.kJ/mol,H2S不完全燃烧生成固态硫和液态水.写出H2S不完全燃烧的热化学方程式 ;
(2)SO2溶于水生成弱酸H2SO3,写出H2SO3的电离方程式 ;
(3)Na2SO3溶液通常现用现配,写出Na2SO3溶液所含离子浓度的大小关系(由大到小) ;
(4)向1L0.1mol/L的NaOH溶液中不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变),请在图中画出SO2通入过程中溶液中各阴离子浓度与SO2物质的量的关系变化图象(如图中OH-所示).
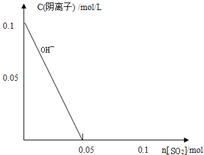
查看习题详情和答案>>
(1)已知S的燃烧热为297kJ?mol-1,H2S完全燃烧的热化学方程式为H2S(g)+1.5O2(g)=SO2(g)+H2O (l)△H=-586.kJ/mol,H2S不完全燃烧生成固态硫和液态水.写出H2S不完全燃烧的热化学方程式
(2)SO2溶于水生成弱酸H2SO3,写出H2SO3的电离方程式
(3)Na2SO3溶液通常现用现配,写出Na2SO3溶液所含离子浓度的大小关系(由大到小)
(4)向1L0.1mol/L的NaOH溶液中不断通入标准状况下的SO2气体2.24L(假设溶液体积一直保持不变),请在图中画出SO2通入过程中溶液中各阴离子浓度与SO2物质的量的关系变化图象(如图中OH-所示).
