摘要:下列情况推断A.B.C.D.E五种有机物的结构简式和名称. (1)分别取1mol A.B.C.D.E在氧气中燃烧.都能生成44.8L的CO2, (2)D被氧化时.先转变成A.再转变成B, (3)在B和D的混合物中加入少量浓硫酸加热.生成水和一种有水果香味的液体, (4)C和E都能发生加成反应, (5)C和适量的氢气加成变成E. 写出相关物质的结构简式:A .B . D .E . 乙酸 乙酸酐 相对分子质量88 相对分子质量46 27.已知:CH3CH2OH ----→ CH3COOC2H5 自动失水 OH 不稳定.R代表烃基 R-CH-OH ----→ R-CH=O + H2O 现有只含C.H.O的化合物A--→F.有关它们的某些信息.已注明在下面的方框内: B 可发生银镜反应 A 可发生银镜反应,可跟钠反应.放出氢气. 乙 酸 乙酸酐 ----→ ----→ E 不发生银镜反应,无酸性 E 不发生银镜反应,无酸性 乙醇 硫酸 乙 酸 乙酸酐 D 相对分子质量106,不发生银镜反应.可被碱中和 ---→ ----→ (1)在化合物A--→F中有酯的结构的化合物是 (2)写出下列化合物的结构简式: A: F:
网址:http://m.1010jiajiao.com/timu3_id_251520[举报]
用质量分数为98%的浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④转移、洗涤 ⑤定容 ⑥摇匀
回答下列问题
(1)若所用浓硫酸密度为1.84g/cm3,则该浓硫酸的物质的量浓度为
(2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)为了保证实验的准确性,在第③和第④步操作之间还应该加多一步什么操作
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的凹液面
查看习题详情和答案>>
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④转移、洗涤 ⑤定容 ⑥摇匀
回答下列问题
(1)若所用浓硫酸密度为1.84g/cm3,则该浓硫酸的物质的量浓度为
18.4mol/L
18.4mol/L
,配制上述稀硫酸所需浓硫酸的体积是16.3mL
16.3mL
(小数点后保留一位),量取浓硫酸所用的量筒的规格是B
B
(从下列中选用A.10ml B.20ml C.50ml D.100ml)(2)第③步实验的操作是
把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,
把浓硫酸沿烧杯壁缓慢倒入盛水的烧杯中,
;不断用玻璃棒搅拌散热,防止溶液飞溅而烫伤操作者
不断用玻璃棒搅拌散热,防止溶液飞溅而烫伤操作者
(3)第⑤步实验的操作是
继续向容量瓶加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切
继续向容量瓶加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切
;(4)为了保证实验的准确性,在第③和第④步操作之间还应该加多一步什么操作
冷却
冷却
,如果在配制溶液过程中出现下列情况对所配稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)A.所用的浓硫酸长时间放置在密封不好的容器中
偏小
偏小
;B.容量瓶用蒸馏洗涤后残留有少量的水
无影响
无影响
;C.所用过的烧杯、玻璃棒未洗涤
偏小
偏小
;D.定容时俯视溶液的凹液面
偏大
偏大
. 用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验有以下步骤:
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验有以下步骤:①计算所用浓硫酸的体积 ②稀释 ③量取一定体积的浓硫酸 ④定容、摇匀 ⑤转移、洗涤
回答下列问题
(1)上述步骤的正确顺序是
①③②⑤④
①③②⑤④
;(2)本实验用到的玻璃仪器有
100mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管
100mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管
;(3)本实验所需浓硫酸的体积是
16.7
16.7
ml,量取浓硫酸所用的量筒的规格是
B
B
.(用序号表示)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)(4)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?(填“偏高”、“偏低”、“无影响”)
偏高
偏高
;若没有进行操作步骤⑤,会
偏低
偏低
(填“偏高”、“偏低”、“无影响”);(5)若加蒸馏水时不慎超过了刻度线,应如何操作?
重新配制
重新配制
.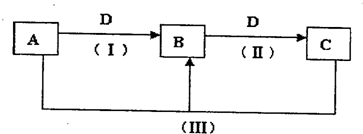 (2011?焦作一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.
(2011?焦作一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,A和D反应生成B的化学方程式为
4NH3+3O2=2N2+6H2O
4NH3+3O2=2N2+6H2O
.B的结构式为N≡N
N≡N
.(2)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,继续灼烧后得到的固体物质成分是
Fe2O3;
Fe2O3;
.(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①C溶液呈碱性的原因是
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.(用离子方程式表示)②将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.已知五种短周期元素,A、B、C、D、E的核电荷数依次增大,其中B、E同主族,A元素的氢化物是被称为高效、较纯净的燃料;B元素是地壳中含量最多的元素;C、D、E三种原子的最外电子层电子数之和为10,且这三种元素的最高氧化物对应水化物之间两两皆能反应,均生成盐和水.
(1)推断A、B、C、D、E五种元素,写出下列元素名称:
B: C: E:
(2)C2E化合物化学式为 ;
(3)写出化合物AB2的电子式,并判断这种化合物在固态时所属的晶体类型AB2的电子式 ,晶体类型 ;
(4)写出D的单质与E的最高价氧化物的水化物的稀溶液反应的离子方程式为 .
查看习题详情和答案>>
(1)推断A、B、C、D、E五种元素,写出下列元素名称:
B:
(2)C2E化合物化学式为
(3)写出化合物AB2的电子式,并判断这种化合物在固态时所属的晶体类型AB2的电子式
(4)写出D的单质与E的最高价氧化物的水化物的稀溶液反应的离子方程式为
现有A、B、C、D四种化合物的焰色反应均呈黄色.A、B、C分别和足量的盐酸反应后,均可生成D.若将固体C加热后可生成A和无色无味的气体E,若在A溶液中通入足量E,可生成C;若B与C的溶液混合可生成A.请回答下列问题:
(1)推断A、B、C、D的化学式:A
(2)A溶液中通入足量E反应的离子方程式为
(3)B溶液与C溶液反应的离子方程式为
查看习题详情和答案>>
(1)推断A、B、C、D的化学式:A
Na2CO3
Na2CO3
、BNaOH
NaOH
、CNaHCO3
NaHCO3
、DNaCl
NaCl
(2)A溶液中通入足量E反应的离子方程式为
H2O+CO2+CO32-═2HCO3-
H2O+CO2+CO32-═2HCO3-
(3)B溶液与C溶液反应的离子方程式为
HCO3-+OH-═CO32-+H2O
HCO3-+OH-═CO32-+H2O
.