摘要:11.将KClO3和MnO2混合并充分加热.然后在固体残留物中加入浓硫酸.再经加热.可产生的气体是( ) A.O2 B.SO2 C.HCl D.Cl2和HCl
网址:http://m.1010jiajiao.com/timu3_id_251489[举报]
(2013?浦东新区一模)KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.
(1)实验室用KClO3和MnO2混合加热制氧气,现取82.2g KClO3和MnO2混合物共热一段时间后,停止加热,残留物质的质量变为63.0g,则参加反应的KClO3的质量是
(2)有同学在上题残留物63.0g固体中加入足量浓盐酸,加热充分反应,发生的反应如下:
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是
(3)实验室制取氧气时,若MnO2过少,则同时发生4KClO3
3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?
(4)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO).实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?(用小数表示,保留3位小数)
查看习题详情和答案>>
(1)实验室用KClO3和MnO2混合加热制氧气,现取82.2g KClO3和MnO2混合物共热一段时间后,停止加热,残留物质的质量变为63.0g,则参加反应的KClO3的质量是
49g
49g
.(2)有同学在上题残留物63.0g固体中加入足量浓盐酸,加热充分反应,发生的反应如下:
MnO2+4HCl(浓)
| △ |
KClO3、24.5g,MnO2、8.7g,KCl、29.8g
KClO3、24.5g,MnO2、8.7g,KCl、29.8g
.(3)实验室制取氧气时,若MnO2过少,则同时发生4KClO3
| △ |
(4)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO).实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?(用小数表示,保留3位小数)
KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.
(1)实验室用KClO3和MnO2混合加热制氧气,现取82.2g KClO3和MnO2混合物共热一段时间后,停止加热,残留物质的质量变为63.0g,则参加反应的KClO3的质量是______.
(2)有同学在上题残留物63.0g固体中加入足量浓盐酸,加热充分反应,发生的反应如下:
MnO2+4HCl(浓) MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是______.
MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是______.
(3)实验室制取氧气时,若MnO2过少,则同时发生4KClO3 3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?
3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?
(4)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO).实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?(用小数表示,保留3位小数)
查看习题详情和答案>>
(2012?青浦区二模)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为
(2)若剩余的4.80g固体是MnO2和KC1的混合物,则25℃时KC1的溶解度为
原混合物中KClO3的质量为
查看习题详情和答案>>
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为
11.80
11.80
g(保留2位小数).(2)若剩余的4.80g固体是MnO2和KC1的混合物,则25℃时KC1的溶解度为
35g
35g
.原混合物中KClO3的质量为
12.25
12.25
g;所得KC1溶液的密度为l.72g/cm3,则溶液物质的量浓度为5.99
5.99
mol/L(保留2位小数).
实验室常用强氧化剂(如KMnO4、KClO3和MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸反应制备并检验氯气.供选用的实验试剂:a.Na2O2、b.浓盐酸、c.碱石灰、d.NaOH溶液、e.淀粉-KI溶液、f.CaCO3、g.石蕊试液、h.饱和NaCl溶液,装置如图所示(部分导管、蒸馏水略):
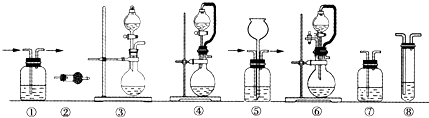
(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式: .
(2)下列装置组合最合理的是 (填序号,需考虑实验结束后拆卸装置时残留有害气体的处理).
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为 .
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:① ,② .
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一? (填“是”、“否”),理由是 .
查看习题详情和答案>>

(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式:
(2)下列装置组合最合理的是
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③ | ① | ⑧/e | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/e | ① |
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:①
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?