题目内容
KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.
(1)实验室用KClO3和MnO2混合加热制氧气,现取82.2g KClO3和MnO2混合物共热一段时间后,停止加热,残留物质的质量变为63.0g,则参加反应的KClO3的质量是______.
(2)有同学在上题残留物63.0g固体中加入足量浓盐酸,加热充分反应,发生的反应如下:
MnO2+4HCl(浓) MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是______.
MnCl2+Cl2+2H2O KClO3+6HCl(浓)→KCl+3Cl2+3H2O待固体完全溶解后,共收集到15.68L的Cl2(标准状况下,假设Cl2无损耗).则残留物中各种物质的质量是______.
(3)实验室制取氧气时,若MnO2过少,则同时发生4KClO3 3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?
3KClO4+KCl.现取98g KClO3和少量MnO2,充分加热(MnO2不变化),若反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,则标准状况下收集到O2多少升?
(4)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO).实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?(用小数表示,保留3位小数)
(1)利用2KClO3 2KCl+3O2↑及差量法计算;
2KCl+3O2↑及差量法计算;
(2)根据化学反应及差量法可计算生成的KCl的质量,可确定残留物中KClO3和MnO2混合物的质量,再结合MnO2+4HCl(浓) MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;
MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;
(3)根据电子守恒来计算生成的氧气;
(4)测定溶液中n(K+):n(Cl-)=14:11,结合氯气与KOH反应生成氯酸钾和KCl或KClO和KCl来计算质量分数的范围.解:(1)设参加反应的KClO3的质量为x,则
2KClO3 2KCl+3O2↑ 固体△m
2KCl+3O2↑ 固体△m
245 149 96 96
x 82.2g-63.0g
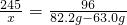 ,解得x=49g,故答案为:49g;
,解得x=49g,故答案为:49g;
(2)设生成KCl的质量为y,则
2KClO3 2KCl+3O2↑ 固体△m
2KCl+3O2↑ 固体△m
245 149 96 96
y 82.2g-63.0g
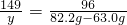 ,解得y=29.8g,
,解得y=29.8g,
则KClO3和MnO2混合物的质量为63.0g-29.8g=33.2g,
n(Cl2)= =0.7mol,
=0.7mol,
设氯酸钾的质量为m,二氧化锰的质量为n,则
MnO2+4HCl(浓) MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
87 1
n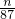 mol
mol
KClO3+6HCl(浓)→KCl+3Cl2+3H2O
122.5 3
m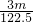 mol
mol
所以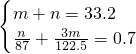 ,解得m=24.5g,n=8.7g,
,解得m=24.5g,n=8.7g,
故答案为:KClO3、24.5g,MnO2、8.7g,KCl、29.8g;
(3)98gKClO3的物质的量为 =0.8mol,反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,
=0.8mol,反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,
被氧化的Cl为0.8mol×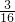 =0.15mol,则被还原的Cl为0.8mol-0.15mol=0.65mol,
=0.15mol,则被还原的Cl为0.8mol-0.15mol=0.65mol,
设生成氧气为zmol,4KClO3 3KClO4+KCl、2KClO3
3KClO4+KCl、2KClO3 2KCl+3O2↑,
2KCl+3O2↑,
由电子守恒可知,0.65×6=0.15×2+z×2×2,
解得z=0.9mol,则氧气的体积为0.9mol×22.4L/mol=20.16L,
答:标准状况下收集到O2为20.16L;
(4)测定溶液中n(K+):n(Cl-)=14:11,设钾离子为14mol,氯离子11mol,
①由零价氯变成负一价的,一共需要得到11mol电子,如果剩下的K离子是氯酸钾和次氯酸钾,
由得失电子守恒可知氯酸钾是2mol,次氯酸钾是1mol,
所以得到的晶体是11molKCl,1molKClO,2molKClO3,
氯酸钾的质量分数是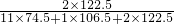 ×100%=0.212,
×100%=0.212,
②由零价氯变成负一价的,一共需要得到11mol电子,若其余为氯酸钾和氢氧化钾的混合物,由得失电子守恒可以得到氯酸钾是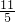 =2.2mol,
=2.2mol,
那么氢氧化钾是14mol-11mol-2.2mol=0.8mol,
所以氯酸钾的质量分数是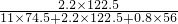 ×100%=0.238,
×100%=0.238,
答:得到的固体中KClO3的质量分数的取值范围为0.212~0.238.
分析:(1)利用2KClO3 2KCl+3O2↑及差量法计算;
2KCl+3O2↑及差量法计算;
(2)根据化学反应及差量法可计算生成的KCl的质量,可确定残留物中KClO3和MnO2混合物的质量,再结合MnO2+4HCl(浓) MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;
MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;
(3)根据电子守恒来计算生成的氧气;
(4)测定溶液中n(K+):n(Cl-)=14:11,结合氯气与KOH反应生成氯酸钾和KCl或KClO和KCl来计算质量分数的范围.
点评:本题考查氧化还原反应的计算,题目难度较大,注意发生的氧化还原反应及电子守恒、原子守恒的应用,(4)为解答的难点,计算较繁琐.
 2KCl+3O2↑及差量法计算;
2KCl+3O2↑及差量法计算;(2)根据化学反应及差量法可计算生成的KCl的质量,可确定残留物中KClO3和MnO2混合物的质量,再结合MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;
MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;(3)根据电子守恒来计算生成的氧气;
(4)测定溶液中n(K+):n(Cl-)=14:11,结合氯气与KOH反应生成氯酸钾和KCl或KClO和KCl来计算质量分数的范围.解:(1)设参加反应的KClO3的质量为x,则
2KClO3
 2KCl+3O2↑ 固体△m
2KCl+3O2↑ 固体△m245 149 96 96
x 82.2g-63.0g
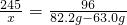 ,解得x=49g,故答案为:49g;
,解得x=49g,故答案为:49g; (2)设生成KCl的质量为y,则
2KClO3
 2KCl+3O2↑ 固体△m
2KCl+3O2↑ 固体△m245 149 96 96
y 82.2g-63.0g
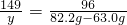 ,解得y=29.8g,
,解得y=29.8g,则KClO3和MnO2混合物的质量为63.0g-29.8g=33.2g,
n(Cl2)=
 =0.7mol,
=0.7mol,设氯酸钾的质量为m,二氧化锰的质量为n,则
MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O87 1
n
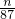 mol
molKClO3+6HCl(浓)→KCl+3Cl2+3H2O
122.5 3
m
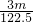 mol
mol所以
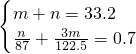 ,解得m=24.5g,n=8.7g,
,解得m=24.5g,n=8.7g,故答案为:KClO3、24.5g,MnO2、8.7g,KCl、29.8g;
(3)98gKClO3的物质的量为
 =0.8mol,反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,
=0.8mol,反应中被氧化的氯元素和被还原的氯元素的物质的量之比为3:13,被氧化的Cl为0.8mol×
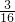 =0.15mol,则被还原的Cl为0.8mol-0.15mol=0.65mol,
=0.15mol,则被还原的Cl为0.8mol-0.15mol=0.65mol,设生成氧气为zmol,4KClO3
 3KClO4+KCl、2KClO3
3KClO4+KCl、2KClO3 2KCl+3O2↑,
2KCl+3O2↑,由电子守恒可知,0.65×6=0.15×2+z×2×2,
解得z=0.9mol,则氧气的体积为0.9mol×22.4L/mol=20.16L,
答:标准状况下收集到O2为20.16L;
(4)测定溶液中n(K+):n(Cl-)=14:11,设钾离子为14mol,氯离子11mol,
①由零价氯变成负一价的,一共需要得到11mol电子,如果剩下的K离子是氯酸钾和次氯酸钾,
由得失电子守恒可知氯酸钾是2mol,次氯酸钾是1mol,
所以得到的晶体是11molKCl,1molKClO,2molKClO3,
氯酸钾的质量分数是
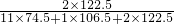 ×100%=0.212,
×100%=0.212,②由零价氯变成负一价的,一共需要得到11mol电子,若其余为氯酸钾和氢氧化钾的混合物,由得失电子守恒可以得到氯酸钾是
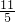 =2.2mol,
=2.2mol,那么氢氧化钾是14mol-11mol-2.2mol=0.8mol,
所以氯酸钾的质量分数是
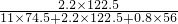 ×100%=0.238,
×100%=0.238,答:得到的固体中KClO3的质量分数的取值范围为0.212~0.238.
分析:(1)利用2KClO3
 2KCl+3O2↑及差量法计算;
2KCl+3O2↑及差量法计算;(2)根据化学反应及差量法可计算生成的KCl的质量,可确定残留物中KClO3和MnO2混合物的质量,再结合MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;
MnCl2+Cl2+2H2O、KClO3+6HCl(浓)→KCl+3Cl2+3H2O及收集到15.68L的Cl2来计算;(3)根据电子守恒来计算生成的氧气;
(4)测定溶液中n(K+):n(Cl-)=14:11,结合氯气与KOH反应生成氯酸钾和KCl或KClO和KCl来计算质量分数的范围.
点评:本题考查氧化还原反应的计算,题目难度较大,注意发生的氧化还原反应及电子守恒、原子守恒的应用,(4)为解答的难点,计算较繁琐.

练习册系列答案
相关题目
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.