摘要:思考:(1)在C2H2 .C3H6.C2H4.C4H10.C6H10中.肯定属于烯烃的是 .肯定属于炔烃的是 .肯定属于烷烃的是 .若C6H10为链烃.则不饱和的碳原子可能有 个. (2).写出甲烷.乙烯.乙炔.苯的结构式和结构简式,它们的键角分别是多少?空间构型分别属于哪种类型? 例1:下列混合气体.其含碳百分率一定比乙烯高的是 .一定低的是 A.乙烯和丁烯 B.乙炔和丙烯 C.乙炔和乙烷 D.乙烯和乙烷 例2:某烃分子中含有一个环状结构和两个双键.其可能有的分子式为 A.C4H6 B.C7H8 C.C5H6 D.C10H15N2Cl3 E.C8H14O2 例3:描述分子结构的下列叙述中.正确的是 A.6个碳原子有可能都在一条直线上 B.6个碳原子不可能都在一条直线上 C.6个碳原子有可能都在同一平面上 D.6个碳原子不可能都在同一平面上
网址:http://m.1010jiajiao.com/timu3_id_251235[举报]
依据事实,写出下列反应的热化学方程式.
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量:
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量:
查看习题详情和答案>>
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1
| 3 |
| 2 |
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1
.| 3 |
| 2 |
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量:
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ?mol-1
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ?mol-1
.(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量:
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ?mol-1
| 5 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ?mol-1
.| 5 |
| 2 |
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l-2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含
②乙同学认为氧化性:Fe3+<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
(3)设计实验并验证
丙同学为验证乙同学的观点.选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)结论:氧化性:Fe3+<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为
(5)实验后的思考:在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为
查看习题详情和答案>>
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含
Br2
Br2
(填化学式,下同)所致.②乙同学认为氧化性:Fe3+<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
Fe3+
Fe3+
所致.(3)设计实验并验证
丙同学为验证乙同学的观点.选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | b b |
下层(CCl4层)无色 下层(CCl4层)无色 |
| 方案2 | d d |
溶液变为血红色 溶液变为血红色 |
2Fe2++Br2=2Fe3++2Br-
2Fe2++Br2=2Fe3++2Br-
.(5)实验后的思考:在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为
4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
.目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
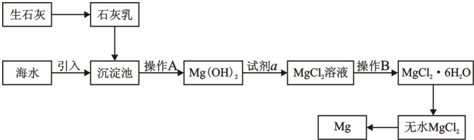
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
(3)操作A是
(4)加入的足量试剂a是
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你
查看习题详情和答案>>

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀)
,写出在沉淀池的离子方程式Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的
贝壳
贝壳
.(3)操作A是
过滤
过滤
,操作B是加热浓缩
加热浓缩
.(4)加入的足量试剂a是
HCl
HCl
(填化学式).(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.从考虑成本和废物循环利用的角度,副产物氯气可以用于
| ||
制盐酸,循环使用
制盐酸,循环使用
.(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,
且成本低.
且成本低.
海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,
且成本低.
.且成本低.
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你
不同意
不同意
(填“同意”或“不同意”)该同学的想法,理由是MgO熔点很高,熔融时耗费大量的能量而增加生产成本
MgO熔点很高,熔融时耗费大量的能量而增加生产成本
.海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,如图是某化工厂对海水资源综合利用的示意图.
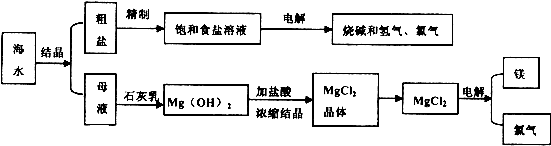
回答下列问题:
(1)请写出电解食盐水的离子方程式 .
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁.
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是 .
②石灰乳是生石灰与水作用形成的物质,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是 .
③电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号) .
A.H2 8.CO2 C.空气 D.氩气 E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质,生成溴单质的化学反应的离子方程式是一工业生产中将溴单质从混合物中分离出来是利用溴单质具有 性.
查看习题详情和答案>>

回答下列问题:
(1)请写出电解食盐水的离子方程式
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁.
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是
②石灰乳是生石灰与水作用形成的物质,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是
③电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)
A.H2 8.CO2 C.空气 D.氩气 E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质,生成溴单质的化学反应的离子方程式是一工业生产中将溴单质从混合物中分离出来是利用溴单质具有