摘要:18.进行铝热反应时可用Fe3O4代替Fe2O3.产生同样的物质.试写出该反应的化学反应方程式.并加以配平.
网址:http://m.1010jiajiao.com/timu3_id_250082[举报]
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
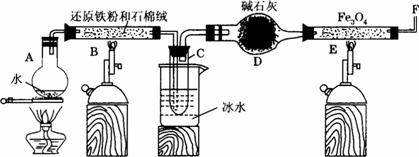
(1)为防止A中液体暴沸,可以采取的措施是___________;装置D能否改用盛有浓硫酸的洗气瓶___________。
(2)反应3Fe+4H2O(g)====Fe3O4+4H2↑在一定条件下实际为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释__________________________________。
(3)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象_____________________________________________________。
(4)若E管中反应按以下两步进行:Fe3O4+H2====3FeO+H2O,FeO+H2====Fe+H2O,假设实验开始时E管中的Fe3O4为23.
①Fe ②Fe租Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉_________g(不考虑空气中的成分参与反应)。
查看习题详情和答案>>粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20g A全部溶于0.20L 4.5mol?L-1的盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时溶液D不变色,请填空:
(1)①中发生的反应的化学方程式是
(2)③中所发生的各反应的离子方程式是
(3)若溶液D的体积仍视为0.20L,计算溶液中Mg2+、Fe2+的浓度.
查看习题详情和答案>>
(1)①中发生的反应的化学方程式是
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
(2)③中所发生的各反应的离子方程式是
Fe+2H+═Fe2++H2↑,Fe+2Fe3+═3Fe2+
Fe+2H+═Fe2++H2↑,Fe+2Fe3+═3Fe2+
.(3)若溶液D的体积仍视为0.20L,计算溶液中Mg2+、Fe2+的浓度.
(2006?揭阳二模)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;②
另取20g A全部溶于0.15L 6.0mol/L盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.
请回答:
(1)①产物中的单质B是
(2)②中所发生的各反应的化学方程式是
(3)③中所发生的各反应的离子方程式是
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为
查看习题详情和答案>>
①取适量A进行铝热反应,产物中有单质B生成;②
另取20g A全部溶于0.15L 6.0mol/L盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.
请回答:
(1)①产物中的单质B是
Fe
Fe
.(2)②中所发生的各反应的化学方程式是
MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O
MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O
.(3)③中所发生的各反应的离子方程式是
Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+
Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+
.(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为
0.67mol/L
0.67mol/L
,c(Fe2+)为2.33mol/L
2.33mol/L
.
某实验小组的同学为探究铁及其化合物的性质,进行了如下实验,请按照要求回答下列问题:
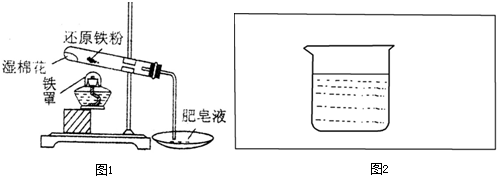
(1)甲同学为了探究铁与水是否反应,先向一只试管中加入少量还原铁粉和适量蒸馏水,观察现象;然后再将其加热,观察现象.根据上述实验,得出的结论是 .接着他又按如图1所示装置进行实验.图中湿棉花的作用是 ,试管中发生反应的化学方程式为 .
(2)乙同学在一块覆满铜的绝缘板上,用熔化的蜡写了个字,待蜡凝固后,将绝缘板浸没在盛有FeCl3溶液的小烧杯中,再将小烧杯放入盛有热水的大烧杯中.一段时间后,用镊子取出绝缘板,用水冲洗后除去蜡,发现只有字迹处留有亮红色的铜.实验中热水的作用是 ,Fe3+作 剂(填“氧化”、“还原”或“催化”).
(3)丙同学想利用FeCl3溶液、铁棒、碳棒、导线、烧杯、电流计(用“ ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
(4)丁同学利用如图1装置,进行铝热反应的实验.若生成a g铁,至少需要还原剂的物质的量为 mol.
查看习题详情和答案>>

(1)甲同学为了探究铁与水是否反应,先向一只试管中加入少量还原铁粉和适量蒸馏水,观察现象;然后再将其加热,观察现象.根据上述实验,得出的结论是
(2)乙同学在一块覆满铜的绝缘板上,用熔化的蜡写了个字,待蜡凝固后,将绝缘板浸没在盛有FeCl3溶液的小烧杯中,再将小烧杯放入盛有热水的大烧杯中.一段时间后,用镊子取出绝缘板,用水冲洗后除去蜡,发现只有字迹处留有亮红色的铜.实验中热水的作用是
(3)丙同学想利用FeCl3溶液、铁棒、碳棒、导线、烧杯、电流计(用“
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).(4)丁同学利用如图1装置,进行铝热反应的实验.若生成a g铁,至少需要还原剂的物质的量为