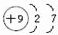摘要:氮原子结构示意图为 .氨分子的结构式为 .氨分子的形状为 . 27. 甲烷的电子式为 .甲烷与氯气的混合物在光照下发生反应有可能产生多种生成物.其中极易溶于水的是 .氯仿的分子式是 . 28.写出各物质相应的名称: (1)CH3CH2CH3 , (2) , (3) .它的分子式是 .29. .写出下列反应的化学方程式 (1).实验室制取NH3: (2).实验室用电石(CaC2)和水反应制乙炔: (3).金属铜溶于浓硝酸:
网址:http://m.1010jiajiao.com/timu3_id_250018[举报]
下表是元素周期表的一部分.
(1)表中所列元素中,最稳定的气态氢化物的化学式
(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是
 .
.
(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元素”,此元素的名称为
 ,用化学方程式表示其单质的一种重要的工业用途:
,用化学方程式表示其单质的一种重要的工业用途:
(4)④与⑥形成原子个数之比为1:1的化合物的电子式为
 ,用电子式表示⑤和⑩形成化合物的过程
,用电子式表示⑤和⑩形成化合物的过程

(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中
⑨的单质通入⑥和(11)形成化合物的水溶液中
查看习题详情和答案>>
| 族 周期 |
II A | IV A | VII A | ||||
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| ⑥ | ⑦ | ⑧ | ⑨ | ||||
| ⑩ | (11) | ||||||
HF
HF
,原子半径最小的元素的元素符号是H
H
.(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是
Mg
Mg
,其元素原子结构示意图为

(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元素”,此元素的名称为
氮
氮
,其单质的电子式为

N2+3H2
2NH3
| 高温高压 |
| 催化剂 |
N2+3H2
2NH3
.| 高温高压 |
| 催化剂 |
(4)④与⑥形成原子个数之比为1:1的化合物的电子式为




(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
⑨的单质通入⑥和(11)形成化合物的水溶液中
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
.(2013?房山区一模)碳化硅(SiC)、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
(1)Al的原子结构示意图为
 ;Al与NaOH溶液反应的离子方程式为
;Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g)△H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g.
①H2的平均反应速率是
②平衡时容器内N2的浓度是
③SiCl4(g)的转化率是
④若按n(SiCl4):n(N2):n(H2)=3:2:6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应
⑤在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现.下列四种投料方式,其中可行的是
查看习题详情和答案>>
(1)Al的原子结构示意图为


2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为
Si3N4+16HF=4NH4F+3SiF4
Si3N4+16HF=4NH4F+3SiF4
.(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
| 高温 |
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g.
①H2的平均反应速率是
0.024
0.024
mol/(L?min).②平衡时容器内N2的浓度是
0.06
0.06
mol?L-1.③SiCl4(g)的转化率是
40%
40%
.④若按n(SiCl4):n(N2):n(H2)=3:2:6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应
减小
减小
(填“增大”、“减”或“不变”).⑤在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现.下列四种投料方式,其中可行的是
AB
AB
.| 选项 | 投料方式 |
| A | n(SiCl4):n(N2):n(H2)=1:1:2 |
| B | n(SiCl4):n(N2):n(H2)=1:2:2 |
| C | n(SiCl4):n(N2):n(H2)=3:2:2 |
| D | n(SiCl4):n(N2):n(H2)=2:1:3 |
Ⅰ.用尿素、氢氧化钠和水作为溶剂,预冷至零下12℃,能将极难溶解的纤维素溶化为粘液.武汉大学张俐娜教授因此而荣获美国2011年度安塞姆?佩恩奖.
(1)尿素[CO(NH2)2]中元素原子半径最大的原子结构示意图为 ;能说明氧元素原子比氮元素原子得电子能力强的事实是 (填选项).
A.在NO2中氧元素显负价,氮元素显正价
B.H2O的热稳定性比NH3的稳定
C.常温下H2O是液态而NH3是气态
D.O2比N2易液化
(2)尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因 ;
已知:20℃时,H2CO3:Ka1=4.2×10-7;Ka2=5.6×10-11;NH3?H2O:Kb=1.7×10-5
碳酸氢铵溶液中HCO-3、NH+4,OH-、H+四种离子浓度由大到小是 (填选项).
A.c(HCO3-)c(NH4+)c(OH-)c(H+)
B.c(NH4+)c(HCO3-)c(OH-)c(H+)
C.c(HCO3-)c(NH4+)c(H+)c(OH-)
D.c(NH4+)c(HCO3-)c(H+)c(OH-)
Ⅱ.NaNO2外观酷似食盐,误食会中毒.
(3)在酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2.写出此反应的离子方程式 .
(4)工业废水中含少量NO-2,可用电解法将NO-2转换为N2除去.N2将在 极生成,写出NO-2在酸性条件下转化为N2的电极反应式 .
查看习题详情和答案>>
(1)尿素[CO(NH2)2]中元素原子半径最大的原子结构示意图为
A.在NO2中氧元素显负价,氮元素显正价
B.H2O的热稳定性比NH3的稳定
C.常温下H2O是液态而NH3是气态
D.O2比N2易液化
(2)尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因
已知:20℃时,H2CO3:Ka1=4.2×10-7;Ka2=5.6×10-11;NH3?H2O:Kb=1.7×10-5
碳酸氢铵溶液中HCO-3、NH+4,OH-、H+四种离子浓度由大到小是
A.c(HCO3-)c(NH4+)c(OH-)c(H+)
B.c(NH4+)c(HCO3-)c(OH-)c(H+)
C.c(HCO3-)c(NH4+)c(H+)c(OH-)
D.c(NH4+)c(HCO3-)c(H+)c(OH-)
Ⅱ.NaNO2外观酷似食盐,误食会中毒.
(3)在酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,I-被氧化为I2.写出此反应的离子方程式
(4)工业废水中含少量NO-2,可用电解法将NO-2转换为N2除去.N2将在