摘要:复合材料是指两种或两种以上的材料组合成的一种新型材料.其中一种材料作为基体.另外一种材料作为增强剂.所以复合材料可以发挥每一种材料的优点.避免其弱点.因而复合材料一般具有强度高.质量轻.耐高温.耐腐蚀等优异性能. 例题解析 [例1] 下列物质中.属于合成高分子材料的是( ) A.棉花 B.淀粉 C.油脂 D.塑料 [解题思路] 棉花的主要成份是纤维素.淀粉和纤维素是天然的高分子化合物.油脂则属于低分子化合物.塑料是合成高分子化合物. 故应选D. [例2] 耐纶是一种重要的合成纤维.用它可制取具有光泽.坚牢.耐拉和耐化化学腐蚀的人造丝和人造毛.下面是高聚物耐纶分子一部分 -NH-(CH2)6-NH-CO-(CH2)4-CO-NH-(CH2)6-CO-(CH2)4-CO-- (1)合成耐纶的单体有 种. (2)具有碱性的单体的结构简式 种. (3)合成耐纶的反应称 反应. [解题思路] (1)由题给的高聚物耐纶分子的一部分可知.该高聚物应是H2N-(CH2)6-NH2和HOOC-(NH2)4-COOH两种单体缩聚产物.故合成耐纶的单体有两种. O H (2)在上述两种单体中.HOOC-(CH2)4-COOH属于二酸.具有酸性.而H2N-(CH2)6-NH2则属于二胺.具有碱性.故具有碱性的单体结构简式为:H2N-(CH2)6-NH2 (3)合成耐纶所发生的反应是-NH2和-COOH之间缩去H2O分子.以-C-N-键形长链大分子的缩聚过程.故称为缩聚反应. [例3] 当前我国环保急待解决的“白色污染 通常所指的是( ) A.冶炼厂的白色烟尘 B.石灰窑的白色粉尘 C.聚乙烯等塑料垃圾 D.白色建筑废料 [解题思路] “白色污染 主要是指当今人们广泛使用的一次性.不可降解的塑料制品.故应选C. [例4] 工程塑料ABS树脂的结构简式是: [ CH2CHCH2CH==CHCH2CH2CH ] n .合成时用了三种单体.这三种单体是 . . CN C6H5 . [解题思路] 由于链中含一个C=C双键.说明单体中有二烯烃.再根据二烯烃加成时双键的转移规律.这种二烯烃必然是1.3–丁二烯.剩余两种单体由加聚后在链节中的排列不难看出.将其用虚线隔开如下: -CH2CH-CH2CH==CHCH2-CH2-CH- CH C6H5 故三种单体分别为:CH2 = CH–CN CH2 = CHCH = CH2 -OH=CH2 [例5] 下列高分子材料中.属于医用高分子材料可用做人工器官的是( ) A.隐身材料 B.硅聚合物 C.高分子膜 D.聚氨酯 [解题思路] 隐身材料主要用于制隐形眼镜.口腔印模材料等.可排除A,高分子膜根据其特殊功能可分为高分子分离膜.传感膜和热电膜.它们分别用于物质的分离和各种能量的转换上.故可排除C,而硅聚合物和聚氨酯属于医用高分子材料.可用做制人工心脏等人工器官.因而选B.D. [例6] 乳酸在一定条件下所形成的聚酯结构简式为:[ O-CH-C ] n, 该酯可以作为新型的 餐具原料.由它所产生的塑料在乳酸菌作用下.能迅速分解为无毒物质.可以降解.下列有关这种新型的降解的叙述正确的是( ) A.降解塑料是一种纯净物 B.其生产过程中的聚合方式与聚苯乙烯相似 C.它属于一种线型高分子材料 D.其相对分子质量为72 [解题思路] 该降解塑料是乳酸在一定条件下的聚合产物.其聚合度n值总是不同的.它是相对分子质量大小不等的混合物.A错,由乳酸生成其聚酯属于缩聚反应.它的链节彼此连接在一起形成一条长链.属于一种线型高分子化合物.而苯乙烯生成聚苯乙烯发生的则是加聚反应.故B错.C正确.该聚合物的相对分子质量为72n.D错.故应选C. 练习:
网址:http://m.1010jiajiao.com/timu3_id_249076[举报]
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:______,______.
(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是______.
(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式______.
(4)上述实验滴定时,指示剂应该______(填“加”或“不加”),如何判断滴定终点:______.
(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量______.(选填“偏低”“偏高”“不变”)
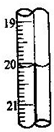
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为______.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是______
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.
查看习题详情和答案>>
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:______,______.
(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是______.
(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式______.
(4)上述实验滴定时,指示剂应该______(填“加”或“不加”),如何判断滴定终点:______.
(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量______.(选填“偏低”“偏高”“不变”)
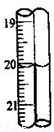
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为______.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是______
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:______,______.
(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是______.
(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式______.
(4)上述实验滴定时,指示剂应该______(填“加”或“不加”),如何判断滴定终点:______.
(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量______.(选填“偏低”“偏高”“不变”)
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为______.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是______
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.
 查看习题详情和答案>>
查看习题详情和答案>>
复合材料是指由两种或两种以上的材料组合成的一种新型 材料。其中一种材料作为基体,另一种材料作为增强剂,这 样可发挥每一种材料的长处,并避免其弱点。下列物质中 不属于复合材料的是
[ ]
A.聚苯乙烯树脂
B.铝塑管
C.涤棉织品
D.纯棉内衣
查看习题详情和答案>>
B.铝塑管
C.涤棉织品
D.纯棉内衣
国际上通行的环保产品概念,至少应满足下列4个条件:①原料能再生;②加工无污染;③对消费者无危害;④废弃后可降解。现不少厂家广告中称其保暖内衣是“绿色”“环保”“生态”产品,有的还宣称纳米技术制造。其实保暖内衣面料一般由3层组成,上下两层为普通高支全棉或涤棉材料,中间层是保暖内衣的保暖精华部分,其生产方法不同、材料不同、性能不同,保暖效果也不同。其中间层通常有3种材料:①聚乙烯薄膜;②涤纶和丙纶复合绒;③羊毛等其他保暖材料,根本不是纳米技术制造。保暖内衣应该具有的散热与储热、透气与抗风、导湿与保温的功能,也许真的要用纳米技术才能解决。
(1)下列说法正确的是_______。
A.全棉是指天然棉花产品
B.涤纶是合成纤维,很难降解
C.保暖内衣有三层,所以保温效果都很好
D.保暖内衣不能透气,否则保暖效果不好
(2)聚乙烯薄膜、涤纶和丙纶复合绒的制造都是以石油作为原料,写出以石油产品乙烯为原料合成聚乙烯的化学方程式______________________________。
(3)上述保暖内衣能否称为环保内衣?为什么?
查看习题详情和答案>>