网址:http://m.1010jiajiao.com/timu3_id_248543[举报]
(A)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mL FeSO4溶液 | 10 mL NH3 | 生成白色沉淀,后变色 |
2 | 20 mL H2S | 10 mL SO2 |
|
3 | 30 mL NO2(主要) | 10 mL H2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mL Cl2 | 40 mL NH3 |
|
试回答下列问题:
(1)实验1中,沉淀最终变为___________色,写出沉淀变色的化学方程式_______________。
(2)实验2甲针筒内的现象是:有________生成,活塞___________移动(填“向外”“向内”或“不”)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入__________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是__________,写出NO2与H2O反应的化学方程式_______________________________。
(4)实验4中,已知:3Cl2+2NH3![]() N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
(B)某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式
_____________________________________________________________________
_____________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是____________________;乙的作用是_____________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是____________________________。集气瓶中收集到的气体的主要成分是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入______________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过_____________(填实验操作名称)即可除去。
查看习题详情和答案>>| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
(1)按A、B、C顺序,三种元素的金属性逐渐
(2)一定条件下,将4.0mol FE2和3.0mol E2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
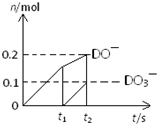
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为
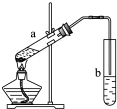
| A、浓硫酸在此反应中作为催化剂、吸水剂 | B、b中导气管不能插入饱和碳酸钠溶液中,目的是防止倒吸 | C、试管a中加入碎瓷片目的是防止剧烈沸腾 | D、先向试管a中加入浓硫酸,然后依次加入酒精、乙酸 |
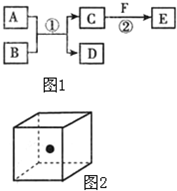 (2010?南宁二模)A、B、C、D、E、F六种物质的相互转化关系如图1所示(反应条件未标出),其中反应①是置换反应.②为化合反应.
(2010?南宁二模)A、B、C、D、E、F六种物质的相互转化关系如图1所示(反应条件未标出),其中反应①是置换反应.②为化合反应.(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A为原子晶体,A、F所含元素同周期,则反应①的化学方程式是
| ||
| ||
(2)图2立方体中心的“●”表示B晶体中半径较大的一个原子,且构成B晶体的两种原子个数比为1:2,请在立方体的顶点用“○”表示出与之相结合的另一种原子的位置.
(3)Ⅰ.若A是常见的金属单质,D、F是气态单质,F呈黄绿色,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是
Ⅱ.将E溶液滴入沸水可得红褐色液体,反应的离子方程式是:
a.光速通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成.
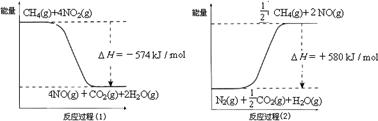
反应过程(2)是
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
| 实验 序号 |
温度℃ | 初始n(CCl4) (mol) |
初始n(H2) (mol) |
平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
③判断该反应的正反应是
④为提高实验3中CCl4的转化率,可采取的措施是
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.