摘要:将固体溴化铵置于密闭容器中.在某温度下发生下列反应: NH4Br(s)NH3H2(g)+Br2(g)两分钟后.反应达到化学平衡.测得氢气的浓度为0.5mol/L, HBr的浓度为4mol/L,则NH3的浓度为 A. 0.5mol/L B.2.5 mol/L C.2 mol/ L D.5 mol/ L
网址:http://m.1010jiajiao.com/timu3_id_248464[举报]
固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,
则下列结论正确的是( )
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,
则下列结论正确的是( )
| A、固体碘化铵一定完全分解 | B、当固体碘化铵物质的量增大一倍,则在相同条件下,容器内压强也增大一倍 | C、平衡时HI分解率为40% | D、平衡时C(NH3)=5mol/L |
将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)![]() NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g)![]() H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则NH3的浓度为( )
H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则NH3的浓度为( )
A.3.5 mol·L-1 B.4 mol·L-1
C.4.5 mol·L-1 D. 5 mol·L-1
查看习题详情和答案>>
将78 g Na2O2和79 g NH4HCO3固体混匀后置于密闭容器中加热至300 ℃待反应完全后排出气体,残存的固体物质是( )
A.106 g Na2CO3和40 g NaOH B.106 g Na2CO3
C.53 g Na2CO3和20 g NaOH D.40 g NaOH
查看习题详情和答案>>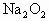 和1mol的
和1mol的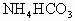 固体混合均匀后置于密闭容器中加热至300℃,待反应完成后,排出气体,残存的固体物质是
固体混合均匀后置于密闭容器中加热至300℃,待反应完成后,排出气体,残存的固体物质是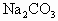 和1mol NaOH
和1mol NaOH