摘要:在一密闭容器中.某可逆反应mX+nYPZ. 在一定条件下达到平衡.已知m+n=p.X是固体.Z是气体.如果对体系加压.则化学平衡向 方向移动.如升高温度时Y的转化率降低.则反应是 热反应.
网址:http://m.1010jiajiao.com/timu3_id_248129[举报]
在一密闭容器中,某可逆反应已达到平衡,若仅改变一个条件,下列叙述正确的是( )
| A、改变容器体积,对气体体积扩大方向的反应速率影响大 | B、改变容器温度,对吸热反应方向的反应速率影响大 | C、改变催化剂,对正、逆反应速率均没有影响 | D、恒压冲入氩气,对气体体积缩小方向的反应速率影响大 |
在一密闭容器中有如下反应:aX (g)+bY(g)?nW(g);△H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
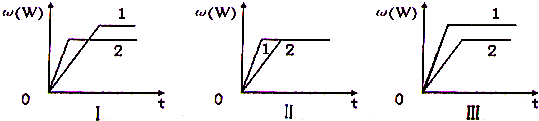
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析不正确的是( )
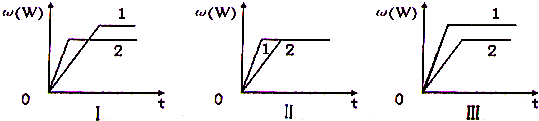
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析不正确的是( )
| A、图I可能是不同压强对反应的影响,且p2>p1,a+b<n | B、图II可能是不同压强对反应的影响,且p1>p2,n<a+b | C、图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 | D、图Ⅲ可能是不同温度对反应影响,且T1>T2,△H>0 |
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3

请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
 .
.
(3)反应③中△H3=
此时反应③中正、逆反应速率的关系式是
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
查看习题详情和答案>>
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3

请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=
0.3mol/(L?min)
0.3mol/(L?min)
;10min时,改变的外界条件可能是升高温度
升高温度
.(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象


(3)反应③中△H3=
-41.2kJ/mol
-41.2kJ/mol
.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a
a
(填代号).a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
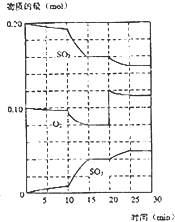 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)写出该反应的化学平衡常数表达式K=
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
(2)降低温度,该反应K值
增大
增大
(填“增大、减小或不变”)(3)在600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是
15-20min
15-20min
和25-30min.(4)在第一次平衡状态时,SO2的转化率是
20%
20%
.(5)在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L.通过计算,判断此混合体系中反应进行的方向.要求写出具体的计算过程.