摘要:元素周期表 元素周期表是元素周期律的具体表现形式. 短周期:第1-3周期 周期 长周期:第4-6周期 不完全周期:第7周期 同周期元素性质递变规律:从左到右.元素的金属性逐渐减弱.非金属性逐渐增强. 主族:ⅠA-ⅦA族 族 副族:ⅠB-ⅦB族 Ⅷ族:由3个纵行组成 0族:稀有气体元素 同主族元素性质递变规律:从上到下.元素的金属性逐渐增强.非金属性逐渐减弱.
网址:http://m.1010jiajiao.com/timu3_id_247918[举报]
表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)最高价氧化物是两性氧化物的元素是
(4)表示①和⑦生成的化合物的电子式
 .
.
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
Ar
Ar
(填元素符号).(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
HClO4
HClO4
,④和⑨的最高价氧化物的水化物碱性强弱的比较:KOH>NaOH
KOH>NaOH
(填相应化学式).(3)最高价氧化物是两性氧化物的元素是
Al
Al
(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
.(4)表示①和⑦生成的化合物的电子式


表是元素周期表的一部分,表中所列的字母分别代表某一元素.

(1)1mol A与足量D的氢化物完全反应产生的气体在标准状况下的体积为
(2)写出B的最高价氧化物的电子式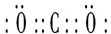
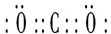 .
.
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化:
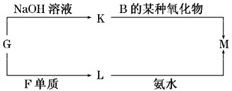
其中化合物M是一种白色胶状沉淀,则M为(填化学式)
查看习题详情和答案>>

(1)1mol A与足量D的氢化物完全反应产生的气体在标准状况下的体积为
11.2L
11.2L
.(2)写出B的最高价氧化物的电子式
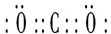
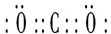
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化:

其中化合物M是一种白色胶状沉淀,则M为(填化学式)
Al(OH)3
Al(OH)3
;K的溶液与B的某种氧化物反应的化学方程式为NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓
NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓
;一种新型无机材料由G元素和C元素组成,其化学式为AlN
AlN
.表是元素周期表的一部分,回答下列有关问题:
(1)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同) ,碱性最强的是 ,呈两性的氢氧化物是 ,
(2)写出工业上冶炼⑤的化学方程式为 ;⑤与一种黑色晶体反应冶炼铁的化学方程式为: .
(3)在⑧与 ⑦中,非金属性较强的元素是 ,写出可以验证该结论的一个离子反应方程式 .
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |  |
 |
(2)写出工业上冶炼⑤的化学方程式为
(3)在⑧与 ⑦中,非金属性较强的元素是
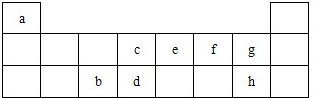 表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:(1)上述所列元素中,最高价氧化物的水化物中酸性最强的是
(2)d、e、f三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)
(3)a、c两种元素可形成多种化合物,其中化合物A的产量是衡量一个国家石油化工发展水平的标志,则:
①A的结构简式为
②A可与H2O反应生成化合物B,该反应类型为
(4)从b、f形成的化合物与d、f形成的化合物的混合物中分离提纯d、f形成的化合物,可加入上述
(5)元素e的气态氢化物与其最高价氧化物的水化物反应生成的物质为
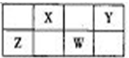 表是元素周期表中短周期的一部分,X、W的质子数之和为23,下列说法正确的是( )
表是元素周期表中短周期的一部分,X、W的质子数之和为23,下列说法正确的是( )