网址:http://m.1010jiajiao.com/timu3_id_247579[举报]
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
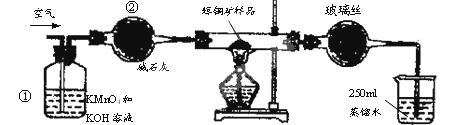
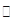 SO2 +2Cu。
SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。 查看习题详情和答案>>
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)、化学计量数a的值为 ;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)、下列说法中能说明该反应达到了化学平衡状态的是 。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)、维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应);与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)、维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为 kJ。
(5)、维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
(6)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 150 | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
查看习题详情和答案>>在T℃条件下,向1L固定体积的密闭容器M中加入2
mol X和1 mol Y,发生如下反应:
2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)、化学计量数a的值为 ;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)、下列说法中能说明该反应达到了化学平衡状态的是 。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)、维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应);与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)、维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为 kJ。
(5)、维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
(6)已知:该反应的平衡常数随温度的变化如下表:
|
温度/℃ |
150 |
200 |
250 |
300 |
350 |
|
平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
查看习题详情和答案>>
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g) 2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)
 2NH3(g) △H<0 。
2NH3(g) △H<0 。氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:

正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g)
 2NH3 (g) △H1
2NH3 (g) △H1② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)
 2NH3(g) △H<0 。
2NH3(g) △H<0 。氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:
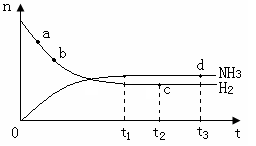
正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)
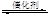 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |