摘要:在常温下.在容积为2L的密闭容器中充入1molNO2.当反应2NO2 N2O4进行2min时达到平衡.测知有0.8molNO2转化为N2O4.试求平衡时: (1).用N2O4表示在2min内反应的平均速率是多少? (2).N2O4的物质的量, (3).混合气体的相对分子质量. 第一学期期中考试试卷
网址:http://m.1010jiajiao.com/timu3_id_247269[举报]
T℃下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2O(g),部分数据见下表(表中t2>t1):
下列说法正确的是( )
查看习题详情和答案>>
| 反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
A.反应在t1min内的平均速率为v(H2)=
| ||
| B.平衡时CO的转化率为66.67% | ||
| C.该温度下反应的平衡常数为1 | ||
| D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol |
T℃下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2O(g),部分数据见下表(表中t2>t1):
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=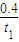 mol?L-1?min-1
mol?L-1?min-1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol
查看习题详情和答案>>
| 反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
| 1.20 | 0.60 | |||
| t1 | 0.80 | |||
| t2 | 0.20 |
A.反应在t1min内的平均速率为v(H2)=
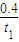 mol?L-1?min-1
mol?L-1?min-1B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol
查看习题详情和答案>>
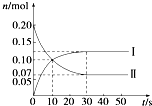 在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.(1)30s时反应达到平衡,用O2表示达到平衡过程的平均反应速率为
0.0022mol?L-1?s-1
0.0022mol?L-1?s-1
,图象中曲线II
II
(选填“Ⅰ”或“Ⅱ”)表示NO2的变化.由图象中曲线和数据变化,能否计算该温度下的平衡常数:不能
不能
(填“能”或“不能”).(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是
放
放
热反应(选填“吸”或“放”).(3)在800℃时,若缩小容器的体积,达新平衡时n(NO)
<
<
(选填“>”、“=”或“<”)0.07mol,NO的转化率增大
增大
(选填“增大”、“不变”或“减小”).(4)上述800℃时的反应达到平衡时测得放出热量a kJ.试写出在此条件下NO与氧气反应的热化学方程式
2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1
.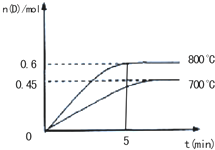 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
(1)800℃时,0-5min内,以B的浓度变化表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
a.容器中压强不变
b.混合气体中c(A)不变
c.2v正(B)=v逆(D)
d.A、B、C、D四者共存
(3)该反应的正反应为
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程).
在容积为2L的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系分别如图1、图2所示.下列说法正确的是( )
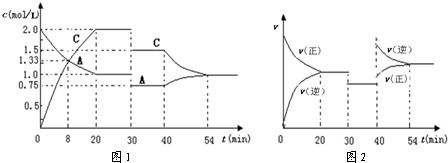

| A、0~20min用A物质表示反应的平均速率为0.05mol?L-1?min-1 | B、该反应的正反应为吸热反应 | C、x=1,且30min时改变的反应条件是减压 | D、在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |