题目内容
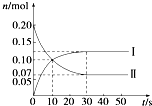 在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.(1)30s时反应达到平衡,用O2表示达到平衡过程的平均反应速率为
0.0022mol?L-1?s-1
0.0022mol?L-1?s-1
,图象中曲线II
II
(选填“Ⅰ”或“Ⅱ”)表示NO2的变化.由图象中曲线和数据变化,能否计算该温度下的平衡常数:不能
不能
(填“能”或“不能”).(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是
放
放
热反应(选填“吸”或“放”).(3)在800℃时,若缩小容器的体积,达新平衡时n(NO)
<
<
(选填“>”、“=”或“<”)0.07mol,NO的转化率增大
增大
(选填“增大”、“不变”或“减小”).(4)上述800℃时的反应达到平衡时测得放出热量a kJ.试写出在此条件下NO与氧气反应的热化学方程式
2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1
.分析:(1)根据图象中NO的物质的量变化,求出浓度变化和反应速率,再根据方程式中计量数关系求出v(O2);曲线Ⅰ表示的物质的量减小是反应物,曲线Ⅱ表示的物质的量增大是生成物;由于缺少平衡时氧气的浓度,所以不能计算平衡常数;
(2)根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,依此判断平衡移动和反应热;
(3)缩小容器体积,压强增大,据此判断平衡移动;
(4)根据参加反应的NO的量和放出的热量,求出2molNO完全反应放出的热量,然后写出热化学方程式.
(2)根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,依此判断平衡移动和反应热;
(3)缩小容器体积,压强增大,据此判断平衡移动;
(4)根据参加反应的NO的量和放出的热量,求出2molNO完全反应放出的热量,然后写出热化学方程式.
解答:解:(1)由图象可知平衡时转化的NO为:n(NO)=0.2-0.07=0.13mol,则v(NO)=
≈0.0022mol?L-1?s-1,所以v(O2)=0.0011mol?L-1?s-1;曲线Ⅰ表示的物质的量减小是反应物,曲线Ⅱ表示的物质的量增大是生成物,所以曲线Ⅱ表示NO2的变化,因为由于氧气的起始浓度不知,所以无法求出平衡时氧气的浓度,所以不能计算平衡常数,
故答案为:0.0022mol?L-1?s-1;II;不能;
(2)根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,与图中的平衡比较,NO物质的量增加了,所以升高温度平衡向逆反应方向移动,故正反应为放热反应,故答案为:放;
(3)缩小容器体积,压强增大,平衡向正反应方向移动,所以NO的物质的量减少,即达新平衡时n(NO)<0.07mol;平衡向正反应方向移动,则NO转化率增大,
故答案为:<;增大;
(4)已知加入的NO的物质的量为0.20mol,但参加反应的只有0.13mol,则2molNO完全反应放出的热量为:
=15.4a kJ,故该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1,
故答案为:2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1.
| ||
| 30s |
故答案为:0.0022mol?L-1?s-1;II;不能;
(2)根据氮元素守恒,当n(NO)=n(NO2)时,n(NO)=n(NO2)=0.1mol,与图中的平衡比较,NO物质的量增加了,所以升高温度平衡向逆反应方向移动,故正反应为放热反应,故答案为:放;
(3)缩小容器体积,压强增大,平衡向正反应方向移动,所以NO的物质的量减少,即达新平衡时n(NO)<0.07mol;平衡向正反应方向移动,则NO转化率增大,
故答案为:<;增大;
(4)已知加入的NO的物质的量为0.20mol,但参加反应的只有0.13mol,则2molNO完全反应放出的热量为:
| 2mol×aKJ |
| 0.13mol |
故答案为:2NO(g)+O2(g)?2NO2(g)△H=-15.4a kJ?mol-1.
点评:本题考查了反应速率和化学平衡的有关知识,涉及反应速率的计算、平衡移动的判断、反应热的计算和热化学方程式的书写等,侧重于基本原理的应用,题目难度中等.

练习册系列答案
相关题目
 (2011?江西)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(2011?江西)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题: 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.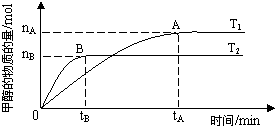 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.