网址:http://m.1010jiajiao.com/timu3_id_246997[举报]
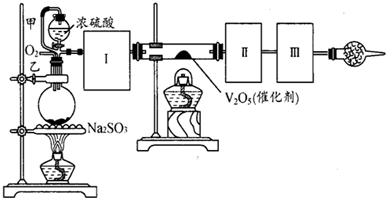
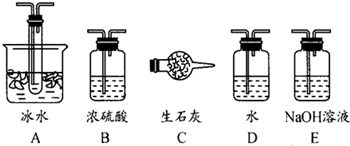
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置.请从图A~E装置中选择最适合装置并将其序号填入下面的空格中.Ⅰ、Ⅱ、Ⅲ处连接的装置分别是
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满).
①原因
②原因
③原因
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为
| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下: 
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。 查看习题详情和答案>>

为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠反应装置图,请回答下列问题:

(1)学生甲得到一组实验数据:
乙醇的物质的量 | 氢气的体积(标准状况) |
0.10 mol | 1.12 L |
根据以上数据推断乙醇的结构应为_________(用Ⅰ、Ⅱ表示),理由为____________________。
(2)学生乙分别准确称量4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况后都小于1.12 L。如果忽略量筒本身及读数造成的误差,那么学生乙认为是由于样品乙醇中含有少量水造成的,你认为正确吗?如果你认为正确,请说明理由;如果你认为不正确,那么产生这种情况的原因应是什么?
(3)学生丙认为实验成功的关键有:①装置气密性良好;②实验开始前准确确定乙醇的量;③钠足量;④广口瓶内必须充满水;⑤氢气体积的测算方法正确、数值准确。其中正确的有________________(填序号)。
(4)学生丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是____________________________________________________________________。
(5)实验后四名学生从乙醇的可能结构分析入手,对乙醇和钠的关系进行讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量取值要求必须是______________________________。
查看习题详情和答案>>【问题1】工业生产碘酸钾的流程如下:
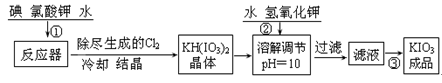
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
经测定乙醇的分子式是C2H6O。由于有机化合物普遍存在同分异构现象,推测乙醇结构可能是下列两种之一:
(Ⅰ)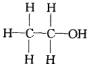 (Ⅱ)
(Ⅱ)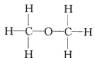
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四名学生直接利用如图给定的装置开始进行实验确定乙醇的结构。
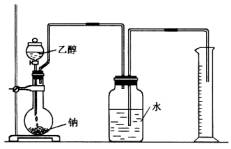
(1)学生甲得到一组实验数据:
|
乙醇的物质的量 |
氢气的体积(标准状况) |
|
0.10mol |
1.12L |
根据以上数据推断乙醇的结构应为________(用Ⅰ、Ⅱ表示),理由是___________。
(2)学生乙分别准确称量4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况后都小于1.12L。如果忽略量筒本身及读数造成的误差,那么学生乙认为是由于样品乙醇中含有少量水造成的,你认为正确吗?答:__________(填“正确”或“不正确”)。如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?答________
(3)学生丙认为实验成功的关键有:①装置气密性良好;②实验开始前准确确定乙醇的量;③钠足量;④广口瓶内必须充满水;⑤氢气体积的测算方法正确、数值准确。其中正确的有__________(填序号)。
(4)学生丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是__________。
(5)实验后四名学生从乙醇的可能结构分析人手对乙醇和钠的量的关系进行讨论,如果乙醇的物质的量为nmol,那么对钠的物质的量的取值要求必须是__________。
查看习题详情和答案>>