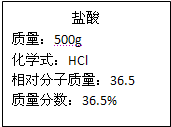
摘要:16.实验室有一瓶浓盐酸.瓶上标签的部分内容如下图所示. 请你根据标签上提供的数据.回答下列问题:这瓶浓盐酸的质量是 g. (1)用 5mL浓盐酸可以配制溶质质量分数为10%的盐酸 g, (2)实验室有10mL和100mL两种规格的量筒.要量取 5mL浓盐酸.使用10mL量筒比用100mL量筒误差小的原因是 . (3)现用刚配好的20g10%的盐酸与足量的锌粒完全反应.制得氢气0.54L.请选择数据.通过计算判断.实验室保存的浓盐酸是否有部分氯化氢挥发?(标准状况.氢气的密度为0.09g/L)
网址:http://m.1010jiajiao.com/timu3_id_24675[举报]
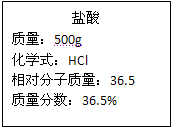 实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:(1)为了证明该瓶盐酸显酸性,你可以采取的做法是
(2)取出200g该浓盐酸,稀释成18.25%的稀盐酸,需要加入水的质量为
(3)现用刚配好的100g 18.25%的盐酸与足量的锌粒完全反应,理论上可以生成氢气的质量是多少?(反应化学方程式:Zn+2HCl=ZnCl2+H2↑)
实验室有一瓶浓盐酸,瓶上标签的部分内容如下图所示,请你根据标签上提供的数据解答下列问题: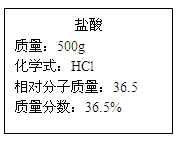
(1)为了证明该瓶盐酸显酸性,你可以采取的做法是 。(简单描述即可)
(2)取出200g该浓盐酸,稀释成18.25%的稀盐酸,需要加入水的质量为 g。
(3)现用刚配好的100g18.25%的盐酸与足量的锌粒完全反应,理论上可以生成氢气的质量是多少?(反应化学方程式:Zn+2HCl= ZnCl2+H2↑)
 实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题: