网址:http://m.1010jiajiao.com/timu3_id_244804[举报]
(1)现行高中化学课本第一册的学生实验一中设计了CuO对KClO3分解的催化作用的实验,某化学兴趣小组对此产生了兴趣,研究CuO和MnO2对KClO3分解的催化性能。
实验装置:

图4-3
实验记录:
实验序号 | 试管中药品 | 加热时间 | 待测数据 |
1 | 20s |
| |
2 | 20s |
|
问题与讨论
①这里的待测数据是__________________________;
②测气体的体积,是选装置(Ⅰ)还是选装置(Ⅱ)?__________________________;
③实验开始时,是先把导管通入量筒中,还是先加热?理由是什么?
____________________________________________________________________
④实验时间到后,应如何操作?
____________________________________________________________________
(2)已知下列反应:2H2O2+2KMnO4+3H2SO4=K2SO4+MnSO4+5O2↑+8H2O。学生在做此实验时发现:在敞口容器中,当H2O2与酸化的KMnO4溶液混合后,开始产生氧气的速率很慢,一段时间后产生氧气的速率很迅速,经测定溶液的温度基本没变,该学生经过思考认为不可能是温度、浓度、压强的影响,只可能是催化剂的影响。为了证实自己的推断,设计了以下对比实验:
①空白实验 ②起始时加入少量K2SO4固体
③起始时加少量______________ ④起始加入少量水
实验结果:起始反应速率③最快,④最慢,①②基本相同
请解释实验①过程中现象产生的原因:_____________________________________________。
查看习题详情和答案>>Ⅰ、影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.

(1)现设计如下实验方案探究温度和c(H2SO4)对锌与稀硫酸反应速率的影响.
①请在表格空白处填写适当的反应条件.
| 编号 | 实验目的 | 锌粒 | 温度 | c(H2SO4) | 需测量的数据 |
| Ⅰ | 为以下实验作参照 | 3粒 | 25℃ | c1 | a |
| Ⅱ | 探究温度对反应速率的影响 | 3粒 | 50℃ | c1 c1 |
b |
| Ⅲ | 探究浓度对反应速率的影响 | 3粒 | 25℃ 25℃ |
c2 | d |
②“需测量的数据”是
(2)对于实验Ⅰ,锌粒与H2SO4反应生成H2的量与反应时间的关系曲线如图2所示.请在图3中画出上述反应的速率(mL/min)与时间(min)的关系曲线图.
Ⅱ、在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸.在不同情况下可能有以下关系:
A.b>a>c B.b>a=c C.c>a>b D.c>a=b E.a=b>c
请从上述选项中选择合适的答案.
(3)当三种酸溶液pH相同时,三者物质的量浓度关系顺序是
(4)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是
(6)将pH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
Na2S2O3+2HCl![]() 2NaCl+S↓+SO2↑+H2O
2NaCl+S↓+SO2↑+H2O
一同学在下午活动课中,配置了0.2 mol·L-1的盐酸置于大烧杯中,并取了3 mL0.1 mol·L-1Na2S2O3溶液与3 mL该盐酸反应,产生明显浑浊约需时间t s。由于时间另有安排,停止了实验。第二天又用了3 mL0.2 mol·L-1的Na2S2O3溶液与原盐酸3 mL反应,产生明显浑浊也需时间t s左右。于是他得出结论:浓度对化学反应速率的影响不大。请你评价该同学的这次实验。
(1)结论是( )
A.可靠的 B.不可靠的
C.基本正确,但有疑点 D.可能正确,也可能不正确
(2)一般对比实验都要控制条件,且再现性好。
①请评价他实验控制的条件:_________。
②请评价他实验现象的对比方法:_________;若他的对比方法不好,请你给出合理的对比方法(若他的对比方法可行;此问可不答) _________。
查看习题详情和答案>>Na2S2O3+2HCl![]() 2NaCl+S+SO2+H2O,一同学在下午活动课中,配制了0.2 mol·L-1的盐酸置于大烧杯中,并取了3 mL 0.1 mol·L-1 的Na2S2O3溶液与3 mL该盐酸反应,产生明显浑浊约需时间t s,由于另有安排,停止了实验。第二天又用了3 mL 0.2 mol·L-1的Na2S2O3溶液与原盐酸反应,产生浑浊的时间也需t s左右。于是他得出结论:浓度对化学反应速率的影响不大,请你评价该同学的这次实验。
2NaCl+S+SO2+H2O,一同学在下午活动课中,配制了0.2 mol·L-1的盐酸置于大烧杯中,并取了3 mL 0.1 mol·L-1 的Na2S2O3溶液与3 mL该盐酸反应,产生明显浑浊约需时间t s,由于另有安排,停止了实验。第二天又用了3 mL 0.2 mol·L-1的Na2S2O3溶液与原盐酸反应,产生浑浊的时间也需t s左右。于是他得出结论:浓度对化学反应速率的影响不大,请你评价该同学的这次实验。
(1)结论是_________。
A.可靠的 B.不可靠的 C.基本正确 D.可能正确,也可能不正确
(2)一般对比实验都要控制条件,且再现性好。
①请评价他实验控制的条件。__________________________________________________。
②请评价他实验现象的对比方法。______________________________________________。
若他的对比方法不好,请你给出正确的对比方法(若他的方法可行,此问可不回答)。___________________________________。
查看习题详情和答案>>已知2NO2(g) N2O4(g)
ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g)
ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧, 并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题
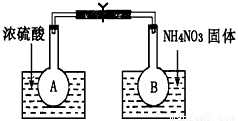
(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
①该同学观察到的现象是:__________________________
②在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
查看习题详情和答案>>