摘要:SO2 + O2
网址:http://m.1010jiajiao.com/timu3_id_243922[举报]
SO2和O2是在催化剂表面上接触时发生反应的,所以这种生产硫酸的方法叫接触法,接触法制硫酸的工艺中SO2的转化率为90%,已知在101kPa 时每l mol SO2被氧化成l mol SO3放出热量98.3kJ,则下列热化学方程式正确的是( )
SO2被空气氧化生成SO3是个放热的可逆反应.实验室根据该反应设计如图所示实验装置来制备SO3固体.请完成下列问题:
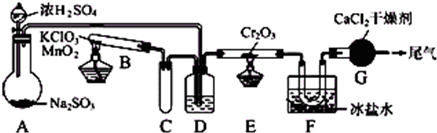
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸.加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①
(5)装置G的作用是
查看习题详情和答案>>

(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
检查装置的气密性
检查装置的气密性
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸.加几滴水的作用是
水与浓硫酸作用放热,有利于SO2的放出
水与浓硫酸作用放热,有利于SO2的放出
(3)小试管C的作用是
缓冲、防止D中的液体倒吸到B中
缓冲、防止D中的液体倒吸到B中
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①
干燥SO2和O2
干燥SO2和O2
②使SO2和O2混合均匀
使SO2和O2混合均匀
③通过观察控制气体比例和气流速度
通过观察控制气体比例和气流速度
(5)装置G的作用是
防止外界水蒸气进入与SO3反应
防止外界水蒸气进入与SO3反应
.SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)?2SO3(g)△H<0.若向一个2L的密闭容器中充入0.4mol SO2、0.2mol O2和0.4mol SO3发生上述反应.
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为
(3)某温度时,将4mol SO2和2mol O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=
查看习题详情和答案>>
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为
0.74
0.74
.(3)某温度时,将4mol SO2和2mol O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=
0.08mol/(L?min)
0.08mol/(L?min)
,该温度下反应2SO2(g)+O2(g)?2S03(g)的平衡常数K=80
80
.