题目内容
SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论.其原因是
①该V L雨水中共溶解的SO2体积是
②若在上述实验中生成沉淀物的质量为4.50g,该雨水中含有H2SO3的物质的量浓度是多少?(要求写出计算过程)
H2SO3+O2=H2SO4
H2SO3+O2=H2SO4
(用化学方程式表示).为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5mol?L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00mL Ba(OH)2溶液.请计算:①该V L雨水中共溶解的SO2体积是
448
448
mL(标准状况).②若在上述实验中生成沉淀物的质量为4.50g,该雨水中含有H2SO3的物质的量浓度是多少?(要求写出计算过程)
分析:二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸;
亚硫酸和氢氧化钡溶液反应生成亚硫酸钡沉淀,硫酸和氢氧化钡溶液生成硫酸钡沉淀,根据原子守恒计算二氧化硫体积;
先根据极限法判断4.50g沉淀物的成分,再根据沉淀的质量计算亚硫酸的物质的量浓度.
亚硫酸和氢氧化钡溶液反应生成亚硫酸钡沉淀,硫酸和氢氧化钡溶液生成硫酸钡沉淀,根据原子守恒计算二氧化硫体积;
先根据极限法判断4.50g沉淀物的成分,再根据沉淀的质量计算亚硫酸的物质的量浓度.
解答:解:二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸H2SO3+O2=H2SO4,亚硫酸是弱酸,硫酸是强酸,等物质的量浓度的亚硫酸和硫酸,硫酸的酸性大于亚硫酸,所以酸雨pH随时间的增加而减小;
故答案为:H2SO3+O2=H2SO4;
①亚硫酸和氢氧化钡溶液反应生成亚硫酸钡沉淀,硫酸和氢氧化钡溶液生成硫酸钡沉淀,根据原子守恒进行计算,
H2SO3+Ba(OH)2=BaSO3↓+2H2O H2SO4+Ba(OH)2=BaSO4↓+2H2O
根据原子守恒知V(SO2)=n(SO2)Vm=[n(H2SO3)+n(H2SO4)]Vm=n[Ba(OH)2]Vm=0.5mol?L-1×0.0400 L×22.4 L?mol-1=448mL;
答:该V L雨水中共溶解的SO2体积是448mL;
②0.5mol/L、40.00mL 的Ba(OH)2溶液和二氧化硫反应,如果全部转化为亚硫酸钡,根据钡原子守恒,则生成亚硫酸钡的质量为:0.02mol×217g/mol=4.34g,如果全部转化为硫酸钡,根据钡原子守恒,则生成硫酸钡的质量为:0.02mol×233g/mol=4.66g,4.34g<4.50g<4.66g,所以沉淀物的组成为BaSO3和BaSO4,
设V L雨水中含有H2SO3的物质的量为n1,含有H2SO4的物质的量为n2
217g?mol-1×n1mol+233g?mol-1×n2mol=4.50g
n1+n2=0.5mol?L-1×0.0400 L=0.02mol
n1=0.01 mol
n2=0.01mol
则c(H2SO3)=
=
mol/L,
答:该雨水中含有H2SO3的物质的量浓度是
mol/L.
故答案为:H2SO3+O2=H2SO4;
①亚硫酸和氢氧化钡溶液反应生成亚硫酸钡沉淀,硫酸和氢氧化钡溶液生成硫酸钡沉淀,根据原子守恒进行计算,
H2SO3+Ba(OH)2=BaSO3↓+2H2O H2SO4+Ba(OH)2=BaSO4↓+2H2O
根据原子守恒知V(SO2)=n(SO2)Vm=[n(H2SO3)+n(H2SO4)]Vm=n[Ba(OH)2]Vm=0.5mol?L-1×0.0400 L×22.4 L?mol-1=448mL;
答:该V L雨水中共溶解的SO2体积是448mL;
②0.5mol/L、40.00mL 的Ba(OH)2溶液和二氧化硫反应,如果全部转化为亚硫酸钡,根据钡原子守恒,则生成亚硫酸钡的质量为:0.02mol×217g/mol=4.34g,如果全部转化为硫酸钡,根据钡原子守恒,则生成硫酸钡的质量为:0.02mol×233g/mol=4.66g,4.34g<4.50g<4.66g,所以沉淀物的组成为BaSO3和BaSO4,
设V L雨水中含有H2SO3的物质的量为n1,含有H2SO4的物质的量为n2
217g?mol-1×n1mol+233g?mol-1×n2mol=4.50g
n1+n2=0.5mol?L-1×0.0400 L=0.02mol
n1=0.01 mol
n2=0.01mol
则c(H2SO3)=
| 0.01mol |
| VL |
| 0.01 |
| V |
答:该雨水中含有H2SO3的物质的量浓度是
| 0.01 |
| V |
点评:本题考查了酸雨pH变化的原因、物质的量的有关计算等知识点,可以根据原子守恒来分析解答,注意②中要先确定沉淀的成分,然后进行计算,为易错点.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用如图所示装置进行实验.

①A装置的作用是 (填“干燥”或“氧化”)SO2气体.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸.
③D装置的作用是 .D中发生反应的化学方程式是 .
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定.说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4.
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为 (填“催化剂’’或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因.
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |
(1)用如图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
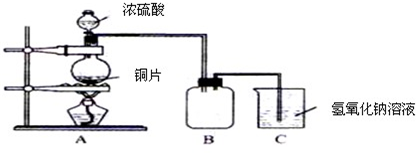
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H 0(“>”、“<”、“=”).前2h内的平均反应速率v(N2)= ,在该温度下,反应的平衡常数K= .据此你认为将该反应从理论转化为现实的最重要的研究方向是 .

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.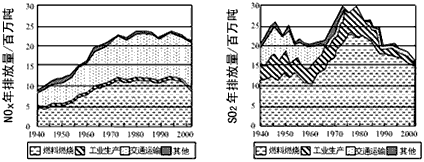
 N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
