网址:http://m.1010jiajiao.com/timu3_id_243542[举报]
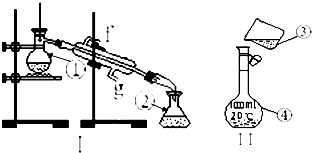 Ⅰ掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
Ⅰ掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.(1)写出下列编号对应的仪器名称
①:
②:
④:
(2)仪器①~④中,使用时必须检查是否漏水的有
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有
(4)现需配250mL 0.2mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是
Ⅱ草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾等.现从草木灰中提取钾盐,并用实验检验其中的 CO32-、SO42- 和 Cl-.
(1)从草木灰中提取钾盐的实验步骤是:①称量→②溶解→③过滤→④(再过滤)→⑤滤液蒸发→⑥冷却结晶
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示
A、左盘重,样品轻 B、左盘轻,砝码重
C、右盘重,砝码轻 D、右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是由于
(4)将制得的少量晶体放入试管,加入蒸馏水溶解,如何证明溶液中有SO42-.
常见的粗盐主要含有NaCl和少量的MgCl2、CaCl2,由于有MgCl2和CaCl2的存在,使得食盐容易板结,下面实验可以确定粗盐中NaCl的质量分数,也可以制得纯净的NaCl,根据实验步骤填写下列空白:
①调整托盘天平零点
②称取样品W克
③将样品溶解于适量的蒸馏水
④滴加稍过量的A溶液,有沉淀产生,沉淀完全后过滤
⑤将得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W1克
⑥滤液中加入稍过量的B溶液,又待沉淀完全后过滤
⑦将⑥得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W2克
⑧在最后得到的滤液中加入稍过量C溶液,加热蒸发溶剂得到纯净NaCl固体W3克
问题:
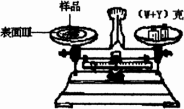
(1)调整天平零点时,若指针偏向左边,应将左边的螺丝帽向(填左、右)________旋转.
(2)某学生用已知质量Y克的表面皿,准确称取W克样品,他在托盘天平的右盘上放入(W+Y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边(如图所示),这时样品的实际质量m________(填>,<,=)W.
(3)加入的试剂A是________,B是________,C是________.
(4)检验步骤④中A是否过量的方法是________.
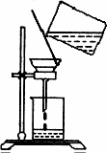
(5)过滤时,某学生的操作如图,明显的错误有________处.
(6)两次洗涤沉淀,为了检验沉淀是否洗净,应在最后几滴洗出液中加入________,若________表示沉淀已洗净.
(7)该粗盐中NaCl的质量分数的计算式是
______________________________________.
| |||||||||||||||||||||||||||

请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①
操作④、⑤用到的主要仪器是:④
(2)判断溶液中SO42-离子已沉淀完全的方法是
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,
(A) 用带有刻度的烧杯配制成100 mL试样溶液
(B) 用量筒量取25.00 mL待测溶液
(C) 并置于锥形瓶中
(D) 用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,
(E) 当溶液变成淡紫红色时,停止滴定,如半分钟内不褪色,
(F) 读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量.
请指出该实验过程中错误操作步骤的编号:
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2

①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
查看习题详情和答案>>
