网址:http://m.1010jiajiao.com/timu3_id_243102[举报]
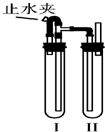 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.①在试管Ⅰ里加入的试剂是
②在试管Ⅱ里加入的试剂是
③为了制得Fe(OH)2白色沉淀,正确的操作顺序是
A.打开止水夹 B.检验试管Ⅱ出口处排出的H2的纯度
C.夹紧止水夹 D.在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子
④写出此过程中涉及到的化学方程式
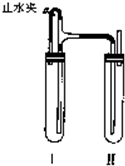 (2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
(2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
(2)除去蒸馏水中溶解的O2常采用
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是
方法二:在如图装置中,用NaOH溶液、铁屑、稀NaSO4等试剂制备.
(1)在试管I里加入的试剂是
(2)在试管Ⅱ里加入的试剂是
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
(1)制备硫酸亚铁溶液,最合适的试剂组为
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
| 烧杯编号 | ① | ② | ③ |
| 加入试剂 | 铁粉0.1g | 铁粉0.1g,0.1mol/L H2SO4 3mL | 0.1mol/L H2SO4 3mL |
| 红色出现时间(天) | 1天 | 4天左右 | 8天以上 |
(4)通过比较上述3组实验,可以得出的结论为
(5)硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大.
①试用一个离子方程式表示上述反应过程中的变化
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因
用下面两种方法可以制得白色的Fe(OH)2沉淀。
 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4和 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
。
查看习题详情和答案>>(12分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4和______。
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下再挤出NaOH溶液。这样操作的理由是_______________________________。
方法二:在如图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管工里加入的试剂是_______________。
(2)在试管Ⅱ里加入的试剂是_______________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________________________________________________。
查看习题详情和答案>>