摘要:常温下物质的量浓度相同的HF.HNO2.HCN.NH3·H2O.H2S溶液.它们的电离平衡常数分别为7.2×10-4.4.6×10-4.4.9×10-10.1.8×10-5 和K1 = 9.1×10-5.K2 = 1.1×10-12.其中.氢离子浓度最小的是 .溶质分子浓度最小的是 .最弱的酸是 .
网址:http://m.1010jiajiao.com/timu3_id_241657[举报]
现有下列电解质溶液:①Na 2CO3 ②NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3>苯酚>HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4 溶液呈中性,根据这一事实推测⑤溶液的pH
查看习题详情和答案>>
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
②④⑤
②④⑤
(2)已知:酸性H2CO3>苯酚>HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填写序号):
①>③>②
①>③>②
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O
| ||
NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O
| ||
(4)已知常温下CH3COONH4 溶液呈中性,根据这一事实推测⑤溶液的pH
>
>
7(填>、=或<),理由是:CH3COONH4溶液呈中性,说明CH3COO-和NH4+水解程度相同,H2CO3酸性弱于CH3COOH,所以HCO3-的水解程度大于CH3COO-,因此NH4HCO3溶液的pH>7
CH3COONH4溶液呈中性,说明CH3COO-和NH4+水解程度相同,H2CO3酸性弱于CH3COOH,所以HCO3-的水解程度大于CH3COO-,因此NH4HCO3溶液的pH>7
.I.将物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(CH3COO-)=c(Na+),则混合后溶液呈
II.常温下,0.1mol?L-1以下列溶液①NaHCO3②NaClO③NH4Cl④NaCl⑤CH3COONa,pH由大到小的排列顺序为
查看习题详情和答案>>
中
中
(填“酸“‘碱”或“中”)性,醋酸与氢氧化钠溶液体积大小关系是V(CH3COOH)>
>
V(NaOH)(填“>”“=”或“<”).II.常温下,0.1mol?L-1以下列溶液①NaHCO3②NaClO③NH4Cl④NaCl⑤CH3COONa,pH由大到小的排列顺序为
②>①>⑤>④>③
②>①>⑤>④>③
(序号表示).25℃时,几种弱酸溶液的pH如下表所示:
(1)25℃时,Na2SO3溶液的pH
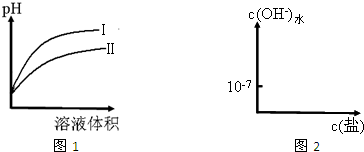
(2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线.
①图1中曲线
②下列操作能使CH3COOH的电离程度与
同时增大的是
A.加水稀释溶液 B.升高溶液温度 C.加入少量NaHSO4固体 D.加入少量CH3COONa固体
③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线.
(3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和
(4)已知:HCN(aq)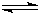 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式:
CN-(aq)+H2O(1)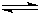 HCN(aq)+OH-(aq)的△H=
HCN(aq)+OH-(aq)的△H=
(需填具体数值,已知10-5.6=2.5×10-6)
查看习题详情和答案>>
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| pH | 3.4 | 2.3 | 5.6 |

(1)25℃时,Na2SO3溶液的pH
>
>
(填“>”、“<”“或“=”)7,其原因是SO32-+H2O HSO3-+OH-
HSO3-+OH-
 HSO3-+OH-
HSO3-+OH-SO32-+H2O HSO3-+OH-
HSO3-+OH-
(用离子方程式表示). HSO3-+OH-
HSO3-+OH-(2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线.
①图1中曲线
Ⅱ
Ⅱ
(填“Ⅰ”或“Ⅱ”)表示加水稀释HCN溶液时pH的变化.②下列操作能使CH3COOH的电离程度与
| c(H+) |
| c(CH3COOH) |
AB
AB
.A.加水稀释溶液 B.升高溶液温度 C.加入少量NaHSO4固体 D.加入少量CH3COONa固体
③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线.
(3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和
>
>
(填“>”、“<”或“=”)NaCN溶液中各离子浓度之和.(4)已知:HCN(aq)
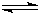 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式:
CN-(aq)+H2O(1)
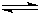 HCN(aq)+OH-(aq)的△H=
HCN(aq)+OH-(aq)的△H=+13.8kJ/mol
+13.8kJ/mol
.该反应25℃时的平衡常数K=1.6×10-5
1.6×10-5
.(需填具体数值,已知10-5.6=2.5×10-6)