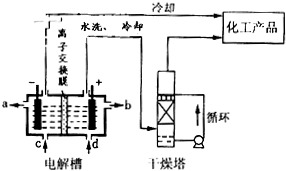
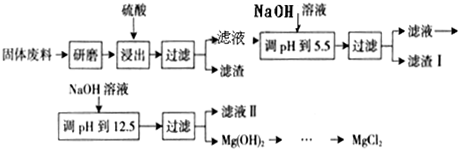
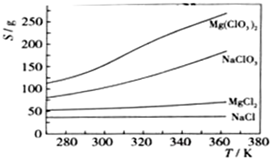
题目内容
I.将物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(CH3COO-)=c(Na+),则混合后溶液呈
II.常温下,0.1mol?L-1以下列溶液①NaHCO3②NaClO③NH4Cl④NaCl⑤CH3COONa,pH由大到小的排列顺序为
中
中
(填“酸“‘碱”或“中”)性,醋酸与氢氧化钠溶液体积大小关系是V(CH3COOH)>
>
V(NaOH)(填“>”“=”或“<”).II.常温下,0.1mol?L-1以下列溶液①NaHCO3②NaClO③NH4Cl④NaCl⑤CH3COONa,pH由大到小的排列顺序为
②>①>⑤>④>③
②>①>⑤>④>③
(序号表示).分析:Ⅰ.从溶液的电中性原则以及电解质的强弱角度分析;
Ⅱ.从盐类水解的程度判断,盐所对应的酸越弱,则对应的盐类水解程度越大,溶液的pH越大.
Ⅱ.从盐类水解的程度判断,盐所对应的酸越弱,则对应的盐类水解程度越大,溶液的pH越大.
解答:解:Ⅰ.将物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),
已知c(CH3COO-)=c(Na+),则c(OH-)=c(H+),所以溶液呈中性,
因醋酸为弱酸,如二者等体积混合,反应后生成CH3COONa,为强碱弱酸盐,溶液呈碱性,为使溶液呈中性,醋酸应稍过量,则醋酸的体积大于氢氧化钠溶液体积,
故答案为:中;>;
Ⅱ.③NH4Cl溶液呈酸性,④NaCl溶液呈中性,①NaHCO3②NaClO⑤CH3COONa都为强碱弱酸盐,溶液呈碱性,
由于酸性:CH3COOH>H2CO3>HClO,盐所对应的酸越弱,则对应的盐类水解程度越大,溶液的pH越大,
则有pH:NaClO>NaHCO3>CH3COONa,
所以:pH由大到小的排列顺序为②>①>⑤>④>③,
故答案为:②>①>⑤>④>③.
已知c(CH3COO-)=c(Na+),则c(OH-)=c(H+),所以溶液呈中性,
因醋酸为弱酸,如二者等体积混合,反应后生成CH3COONa,为强碱弱酸盐,溶液呈碱性,为使溶液呈中性,醋酸应稍过量,则醋酸的体积大于氢氧化钠溶液体积,
故答案为:中;>;
Ⅱ.③NH4Cl溶液呈酸性,④NaCl溶液呈中性,①NaHCO3②NaClO⑤CH3COONa都为强碱弱酸盐,溶液呈碱性,
由于酸性:CH3COOH>H2CO3>HClO,盐所对应的酸越弱,则对应的盐类水解程度越大,溶液的pH越大,
则有pH:NaClO>NaHCO3>CH3COONa,
所以:pH由大到小的排列顺序为②>①>⑤>④>③,
故答案为:②>①>⑤>④>③.
点评:本题考查酸碱混合以及溶液PH的大小比较,题目难度中等,本题注意从溶液电中性的角度比较溶液离子浓度的大小关系,另外把握盐类水解的原理.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
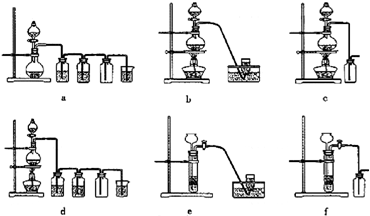
 (2009?沈阳一模)某活动小组利用如图进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕).
(2009?沈阳一模)某活动小组利用如图进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕).