摘要:16.利用元素周期表的有关知识判断,小明对铍元素(Be)及其化合物的性质的推测不正确的是 A.铍原子的半径小于锂原子的半径, B.相同条件下.单质铍与酸反应比单质镁与酸反应剧烈, C.氢氧化铍的碱性比氢氧化钙的碱性弱, D.单质铍不能与冷水剧烈反应.
网址:http://m.1010jiajiao.com/timu3_id_240069[举报]
如图是元素周期表的一部分
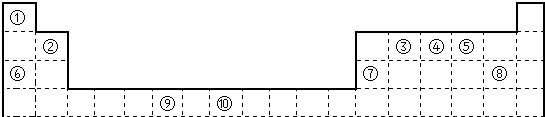
(用对应的元素符号回答下列问题)
(1)写出元素⑨的基态原子的价电子排布图
 ,元素⑩的原子结构示意
,元素⑩的原子结构示意
 .
.
请利用电子排布的相关知识判断元素⑩形成的单核二价阳离子和单核三价阳离子较稳定的是
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式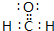
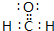 ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为
,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为
(3)元素④的氢化物的分子立体构型为
③④⑤三种元素的第一电离能大小关系是
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与氢氧化钠溶液反应的化学方程式:
(5)随着科学技术的发展,不断有新的元素被发现.若把第七周期排满,则元素周期表共可以排布
查看习题详情和答案>>

(用对应的元素符号回答下列问题)
(1)写出元素⑨的基态原子的价电子排布图




请利用电子排布的相关知识判断元素⑩形成的单核二价阳离子和单核三价阳离子较稳定的是
Fe3+
Fe3+
,原因是:Fe3+的3d轨道处于半满状态,能量较低
Fe3+的3d轨道处于半满状态,能量较低
.(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式
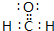
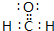
平面三角形
平面三角形
.(3)元素④的氢化物的分子立体构型为
三角锥型
三角锥型
,中心原子的杂化方式sp3
sp3
.③④⑤三种元素的第一电离能大小关系是
N>O>C
N>O>C
、电负性大小关系是O>N>C
O>N>C
.(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与氢氧化钠溶液反应的化学方程式:
Be(OH)2+2NaOH═Na2BeO2+2H2O
Be(OH)2+2NaOH═Na2BeO2+2H2O
.(5)随着科学技术的发展,不断有新的元素被发现.若把第七周期排满,则元素周期表共可以排布
118
118
种元素.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_______区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl??????? B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)已知CaF2晶体(见图)的密度为ρ g·cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

查看习题详情和答案>>
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的______区;溴的价电子排布式为______.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是______.
(3)请根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______.
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列______式发生.
A.CsICl2=CsCl+IClB.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为______,写出一个ClO2-的等电子体______.
(7)已知CaF2晶体(见图)的密度为ρg?cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为______.

查看习题详情和答案>>
(1)卤族元素位于周期表的______区;溴的价电子排布式为______.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是______.
(3)请根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列______式发生.
A.CsICl2=CsCl+IClB.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为______,写出一个ClO2-的等电子体______.
(7)已知CaF2晶体(见图)的密度为ρg?cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为______.

卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_______区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)已知CaF2晶体(见图)的密度为ρ g·cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

(1)卤族元素位于周期表的_______区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)已知CaF2晶体(见图)的密度为ρ g·cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题
(1)C、Si、N元素的电负性由大到小的顺序是____________。C60和金刚石都是碳的同素异形体,金刚石熔点高于C60熔点,原因是_______________。
(2)A、B均为短周期金属元素。依据下表数据和已学知识,
(1)C、Si、N元素的电负性由大到小的顺序是____________。C60和金刚石都是碳的同素异形体,金刚石熔点高于C60熔点,原因是_______________。
(2)A、B均为短周期金属元素。依据下表数据和已学知识,
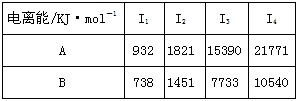
写出B原子的电子排布式:___________________________。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ _______
(填“无”或“有”)颜色
(4)利用CO可以合成化工原料COCl2、络合物Fe(CO)5等。
①已知COCl2分子的结构式为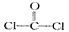 ,则COCl2分子内含_______(填标号)。
,则COCl2分子内含_______(填标号)。
A.4个 键
键
B.2个 键、2个
键、2个 键
键
C.2个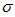 键、1个
键、1个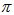 键
键
D.3个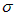 键、1个
键、1个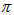 键
键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是_______________。
查看习题详情和答案>>
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ _______
(填“无”或“有”)颜色
(4)利用CO可以合成化工原料COCl2、络合物Fe(CO)5等。
①已知COCl2分子的结构式为
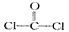 ,则COCl2分子内含_______(填标号)。
,则COCl2分子内含_______(填标号)。A.4个
 键
键 B.2个
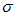 键、2个
键、2个 键
键 C.2个
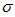 键、1个
键、1个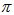 键
键 D.3个
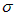 键、1个
键、1个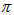 键
键 ②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是_______________。