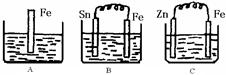
摘要: A.B.C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸 (1)分别写出三个装置中铁片表面发生反应的离子方程式: A ,B ,C . (2)一段时间后.B中Sn极附近溶液的pH (填“增大 .“减小 .“不变 ). (3)一段时间后.C中产生了3.36L气体时.硫酸恰好全部被消耗.则原稀硫酸溶液的物质的量浓度= mol·L-1.此时.三个烧杯中液体质量由大到小的顺序为: . (4)比较A.B.C中铁被腐蚀的速率.由快到慢的顺序是 .
网址:http://m.1010jiajiao.com/timu3_id_239642[举报]
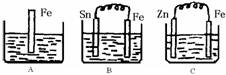
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)A中反应的离子方程式为
(2)一段时间后,B中Sn极附近溶液的pH
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
查看习题详情和答案>>

(1)A中反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)一段时间后,B中Sn极附近溶液的pH
增大
增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L-1.(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
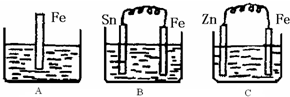
(填写序号).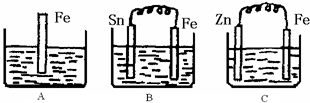 A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸:
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸:(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;BFe-2e-=Fe2+
Fe-2e-=Fe2+
; C2H++2e-=H2↑
2H++2e-=H2↑
.(2)一段时间后,B中Sn(锡)极附近溶液的pH
增大
增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
0.75
0.75
mol?L-1.A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A ;B ;C 。
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为: (填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 (填写序号)。
查看习题详情和答案>>
 稀硫酸
稀硫酸