摘要:某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系.设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究,乙同学设计了如图2装置来验证卤族元素性质的递变规律.A.B.C三处分别是沾有NaBr溶液的棉花.湿润的淀粉KI试纸.湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气. 根据图1回答: (1)写出选用物质的名称:A .B .C , (2)烧瓶中反应的离子方程式为 烧杯中反应的离子方程式为 . 根据图2回答: (3)乙同学的实验原理是 (4)B处的实验现象是 , (5)B处的反应的离子方程式: .
网址:http://m.1010jiajiao.com/timu3_id_239152[举报]
某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色纸条.
已知常温下浓盐酸与高锰酸钾能反应生成氯气.
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液.

(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质:A
②烧杯C中发生反应的离子方程式为
(2)乙同学实验中(图2):
①写出A处反应的离子方程式
②B处实验现象是
③若高锰酸钾的还原产物为Mn2+,当有0.04mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为
查看习题详情和答案>>
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色纸条.
已知常温下浓盐酸与高锰酸钾能反应生成氯气.
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液.

(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质:A
HNO3
HNO3
,BCaCO3
CaCO3
.(填化学式)②烧杯C中发生反应的离子方程式为
CO2+SiO32-+H2O=H2SiO3↓+CO32-
CO2+SiO32-+H2O=H2SiO3↓+CO32-
.(2)乙同学实验中(图2):
①写出A处反应的离子方程式
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.②B处实验现象是
试纸变蓝
试纸变蓝
.③若高锰酸钾的还原产物为Mn2+,当有0.04mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为
2.24
2.24
L.某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
根据图1回答:
(1)写出选用物质的名称:A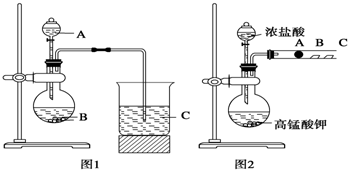
C
(2)烧瓶中反应的离子方程式为
烧杯中反应的离子方程式为
根据图2回答:
(3)乙同学的实验原理是
(4)B处的实验现象是
(5)B处的反应的离子方程式:
查看习题详情和答案>>
根据图1回答:
(1)写出选用物质的名称:A
硝酸
硝酸
,B碳酸钙
碳酸钙

C
硅酸钠溶液
硅酸钠溶液
;(2)烧瓶中反应的离子方程式为
CaCO3+2H+=Ca2++CO2+H2O
CaCO3+2H+=Ca2++CO2+H2O
;烧杯中反应的离子方程式为
SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量)
SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量)
;根据图2回答:
(3)乙同学的实验原理是
强氧化剂生成弱氧化剂或活泼的非金属单质置换出较不活泼的非金属单质
强氧化剂生成弱氧化剂或活泼的非金属单质置换出较不活泼的非金属单质
;(4)B处的实验现象是
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;(5)B处的反应的离子方程式:
2I-+Cl2?I2+2Cl-
2I-+Cl2?I2+2Cl-
. 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)
①、④
①、④
;①稀硫酸溶液; ②浓盐酸; ③石灰石;④碳酸钠粉末;⑤Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
;(2)甲同学所做实验图1烧杯中现象为
出现白色沉淀
出现白色沉淀
;(3)乙同学所做实验图2中B处的现象为
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;(4)写出图2中A处发生反应的离子方程式:
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素的性质递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.(已知常温下浓盐酸与高锰酸钾能反应生成氯气).

(1)甲同学设计的实验,固体B为大理石,试剂A为
①稀硝酸 ②浓盐酸 ③NaOH溶液 ④Na2SiO3溶液
(2)写出图1烧瓶中发生反应的离子方程式
(3)甲同学所做实验图1烧杯中现象为
(4)乙同学所做实验图2中B处的现象为
(5)写出图2中A处发生反应的离子方程式
(6)乙同学用图2来完成实验验证卤素单质氧化性:Cl2>Br2>I2,你认为合理吗?
查看习题详情和答案>>

(1)甲同学设计的实验,固体B为大理石,试剂A为
①
①
(填序号);①稀硝酸 ②浓盐酸 ③NaOH溶液 ④Na2SiO3溶液
(2)写出图1烧瓶中发生反应的离子方程式
2H++CaCO3=Ca2++H2O+CO2↑
2H++CaCO3=Ca2++H2O+CO2↑
;(3)甲同学所做实验图1烧杯中现象为
出现白色沉淀
出现白色沉淀
;(4)乙同学所做实验图2中B处的现象为
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;(5)写出图2中A处发生反应的离子方程式
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
;(6)乙同学用图2来完成实验验证卤素单质氧化性:Cl2>Br2>I2,你认为合理吗?
不合理
不合理
(填“合理”或“不合理”)理由是通过B的气体主要是Cl2,即不能说明氧化性Br2>I2
通过B的气体主要是Cl2,即不能说明氧化性Br2>I2
. 某研究性学习小组设计了一组实验验证元素性质的递变性规律.
某研究性学习小组设计了一组实验验证元素性质的递变性规律.(1)甲同学想验证同周期元素金属性强弱的规律,最好选用第
三
三
周期的钠、镁、铝
钠、镁、铝
三种元素.最简单的实验是将大小相近的三小块金属分别投入相同浓度的稀盐酸中,观察现象.应该看到的现象是:①
钠剧烈反应,可能着火或爆炸
钠剧烈反应,可能着火或爆炸
,②
镁反应较剧烈,产生大量气泡
镁反应较剧烈,产生大量气泡
,③
铝反应比镁缓慢,有较多的气泡产生
铝反应比镁缓慢,有较多的气泡产生
.(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图所示装置以验证氮、碳、硅元素的非金属性强弱.
该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
①写出所选用物质的化学式:
A:
HNO3
HNO3
;B:CaCO3
CaCO3
;C:Na2SiO3
Na2SiO3
.②写出烧杯中发生反应的离子方程式:
CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-
CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-
.