摘要:一直流电压表V.量程为1V.内阻为1000Ω.现将一阻值在5000-7000Ω之间的固定电阻R1与此电压表串联.以扩大电压表的量程.为求得扩大后量程的准确值.再给定一直流电源(电动势E为6-7V.内阻可忽略不计).一阻值R2=2000Ω的固定电阻.两个单刀开关S1.S2及若干导线. (1)为达到上述目的.将答题卡上对应的图连成一个完整的实验电路图. (2)连线完成以后.当S1与S2均闭合时.电压表的示数为0.90 V,当S1闭合.S2断开时.电压表的示数为0.70 V.由此可以计算出改装后电压表的量程为 V.电源电动势为 V.
网址:http://m.1010jiajiao.com/timu3_id_238971[举报]
如图为电解水的实验装置,闭合开关S后,观察到电压表的示数为6.0 V,电流表的示数为100 mA。

(1)此时A管内生成____________气,B管内生成____________气。
(2)试写出电解水的化学方程式。
(3)通电过程中,A极、B极各发生何种化学反应?
(4)为了加快电解水的速率,可在水中加入_____________________________。
A.H2SO4 B.HCl C.NaOH D.NaCl
查看习题详情和答案>>
下图为电解水的实验装置示意图,闭合开关S后,观察到电压表的示数为6.0 V,毫安表的示数为100 mA.
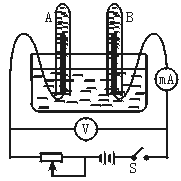
(1)此时A管内生成______气,B管内生成______气.
(2)请写出电解水的化学方程式:______________________________.
(3)通电过程中,A极、B极各发生何种反应(用电极反应式表示)?
(4)为了加快电解水的速率,可在水中加入______(填序号).( )
A.H2SO4 B.HCl C.NaOH D.NaCl
(5)在实验过程中消耗了何种形式的能量,产生了何种形式的能量?
(6)若通电10 min,A管中将生成____mL气体(每个电子带电1.6×10-19 C).
(7)已知每摩尔水被电解消耗280.8 kJ能量,则10 min内增加了多少化学能?______.在电解池中产生了多少内能,在该实验中两极间的电阻是多大?______________.
查看习题详情和答案>>
(2010?天河区一模)下表为元素周期表的一部分,请参照元素A-H在表中的位置,用化学用语回答下列问题:
(1)上述元素中非金属性最强的元素是
(2)B、C、H的最高价含氧酸的酸性由强到弱的顺序是
(3)上述一元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物化合物Z、M,回答下列问题:
①写出物质X的电子式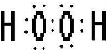
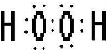 ;
;
②写出Z与Y反应的化学方程式
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | |||||
F
F
,金属性最强的是Na
Na
.(2)B、C、H的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.D、E、F的原子半径由大到小的顺序为Na>O>F
Na>O>F
.(3)上述一元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
;(4)上述某元素的单质在常温下为气态,该元素能与A-H中一种元素构成原子个数比为1:1和1:2的两种共价化合物X、Y,还能与A-H中另一种元素构成原子个数比为1:1和1:2的两种离子化合物化合物Z、M,回答下列问题:
①写出物质X的电子式
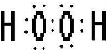
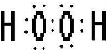
②写出Z与Y反应的化学方程式
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~I在周期表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)I元素在周期表中的位置是第
(4)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和2:1的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
查看习题详情和答案>>
| 纵行 横行 |
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
氮
氮
(写出元素名称),请设计一个简单的实验证明这一结论取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,有无色无味的气体产生,说明酸性硝酸强,N的非金属性强
取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,有无色无味的气体产生,说明酸性硝酸强,N的非金属性强
.(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.(3)I元素在周期表中的位置是第
三
三
周期、第VIIA
VIIA
族.(4)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和2:1的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成原子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
.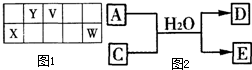 V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如图1示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的红色石蕊试纸变蓝.Z是人体血红蛋白中存在的金属元素.请填写下列空白:
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如图1示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的红色石蕊试纸变蓝.Z是人体血红蛋白中存在的金属元素.请填写下列空白:(1)W的原子结构示意图为
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成,且其中一种化合物的原子个数比为1:1.其反应的化学方程式为
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系(图2)若E为白色沉淀,则E物质的化学式为
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp[X(OH)n]
(5)Y与氢能形成多种化合物,其中一种为Y2H2.2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a