摘要:如图所示.虚线表示等势面.相邻两等势面间的电势差相等.有一带正电的小球在电场中运动.实线表示该小球的运动轨迹.小 球在a点的动能等于20 eV.运动到b点时的动能等于2 eV.若取c点为电势零点.则当这个带电小球的电势能等于-6 eV时.它的动能等于 A.16 eV B.14ev C.6 eV D.4 eV
网址:http://m.1010jiajiao.com/timu3_id_238964[举报]
髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣 (Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题:
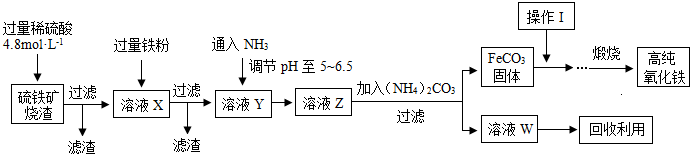
(1)过滤操作中的玻璃仪器为 .
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为 .
(3 )溶液X发生反应的离子方程式为 .
(4)简述如何检验溶液Z中的阴离子 .
(5)操作I的名称是 .列举W的一种用途 .
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示) .
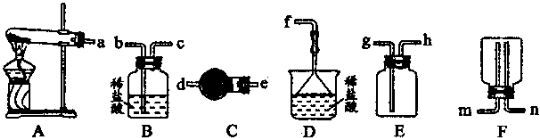
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论 .
查看习题详情和答案>>

(1)过滤操作中的玻璃仪器为
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为
(3 )溶液X发生反应的离子方程式为
(4)简述如何检验溶液Z中的阴离子
(5)操作I的名称是
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)

(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论
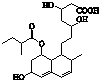 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )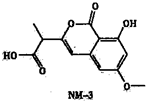 (2013?徐州模拟)NM-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )
(2013?徐州模拟)NM-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )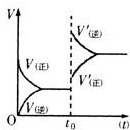 (2011?翠屏区模拟)可逆反应:X+Y?W+Z,反应速率(V)随时间(t)变化的情况如图所示.to表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化.则下列分析正确的是( )
(2011?翠屏区模拟)可逆反应:X+Y?W+Z,反应速率(V)随时间(t)变化的情况如图所示.to表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化.则下列分析正确的是( )