摘要:21.下列物质中含有少量杂质.请在空格中填上适宜的试剂或方法将在杂质除去.并写出相应的方程式(①②写离子方程式.③写化学方程式). 物质 杂质 试剂/方法 离子/化学方程式 ① FeCl2 CuCl2 ②Fe(OH)3 Al(OH)3 ③ Al2O3 Al(OH)3
网址:http://m.1010jiajiao.com/timu3_id_238265[举报]
(12分)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
| 物质 | 杂质 | 试剂 | 化学(离子)方程式 |
| ①CO2 | HCl | | |
| ②Fe(OH)3 | Al(OH)3 | | |
| ③Cu | Mg | | |
(12分)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
|
物质 |
杂质 |
试剂 |
化学(离子)方程式 |
|
①CO2 |
HCl |
|
|
|
②Fe(OH)3 |
Al(OH)3 |
|
|
|
③Cu |
Mg |
|
|
查看习题详情和答案>>
(12分)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
| 物质 | 杂质 | 试剂 | 化学(离子)方程式 |
| ①CO2 | HCl | | |
| ②Fe(OH)3 | Al(OH)3 | | |
| ③Cu | Mg | | |
1-萘乙酸(分子式C12H10O2),是白色针状晶体,常用做植物生长调节剂.
已知:
以萘和氯乙酸为原料生产1-萘乙酸的原理如下: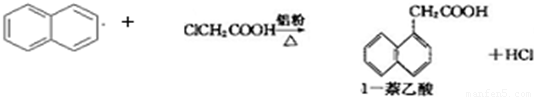
生产的主要流程为:
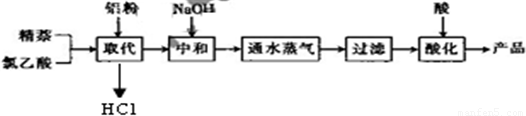
(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
查看习题详情和答案>>
已知:
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
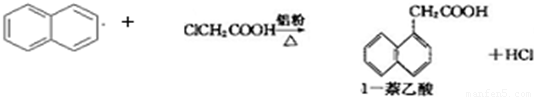
生产的主要流程为:

(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |
查看习题详情和答案>>
1-萘乙酸(分子式C12H10O2),是白色针状晶体,常用做植物生长调节剂.
已知:
以萘和氯乙酸为原料生产1-萘乙酸的原理如下:
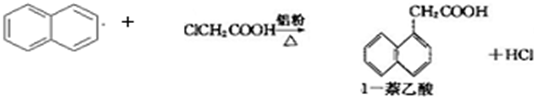
生产的主要流程为:
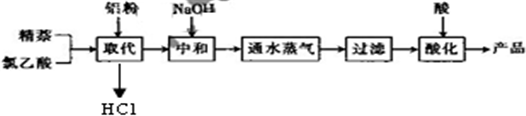
(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
查看习题详情和答案>>
已知:
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
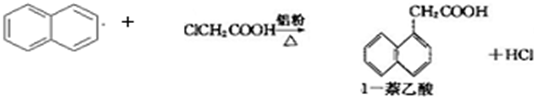
生产的主要流程为:

(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |