摘要:实验收尾 贮存溶液之后.要及时将实验用过的仪器和药品等进行妥善整理.做好实验收尾工作.其中对容量瓶要洗净晾干.并在瓶口与瓶塞处垫张纸条.以免瓶塞与瓶口黏连. [注意] 实验中产生的废弃物要放到指定的容器中.切忌随地乱扔.养成良好的卫生习惯. 小结 配制一定物质的量浓度溶液的过程 ①“二十字 小结法: 计算.称量.溶解.移液.洗涤..装瓶.收尾. ① 图示小结法: 例如:实验室用98%硫酸(ρ=1.84g/cm3)配制0.5 mol/L的稀硫酸250 mL.依照操作的先后顺序将其正确的序号填写在括号内.并在横线上填写数字.仪器的名称.操作方法和图3-24所示序号. ( )用①mL的 ② 准确量取98%硫酸③mL.再小心注入盛有适量蒸馏水的④mL的 ⑤中并不断搅拌.然后冷却静置.如图⑥所示. ( )用约30 mL蒸馏水分3次洗涤⑦和⑧.将每次的洗涤液都倒入⑨ 里.如图⑩ 所示. ( )将已溶解的稀硫酸小心地倒入里.如图(13)所示. 是否发生滴漏.如图(16)所示. ( )将蒸馏水直接加入(17)中.直至液面接近环形刻度线1 cm-2cm处.如图(18)所示. ( )盖紧瓶塞.反复颠倒振荡.摇匀溶液.如图(19)所示. 里逐滴滴人蒸馏水.直至液面的(22)与环形刻度线相切.如图(23)所示. ( )静置片刻.再移入试剂瓶里.贴上标签.如图(24)所示. 答案:(2)①10,②量筒,③6.8,④100,⑤烧杯,⑥C (4)⑦烧杯,⑧玻璃棒,⑨容量瓶,⑩B 容量瓶,(13)E 容量瓶,(16)A E D 容量瓶,F G 又如:某同学配制0.1 mol/L NaOH溶液250 mL.在下列操作中.请指出其中八处错误. ①将托盘天平调好零点使天平平衡.在左.右两盘上各放一张质量相同的白纸.把游码调到1.00g的位置.再用手指轻弹盛有粉末状NaOH的角匙.将药品缓慢撒在左盘的纸片上.直至天平处于平衡状态, ②将称量好的NaOH放入100mL的烧杯中.加入约10mL蒸馏水.充分搅拌使之完全溶解.然后用玻璃棒引流.将溶液移到250 mL的容量瓶里.加入蒸馏水直到距环形刻度线2 cm-3 cm处.再用胶头滴管滴入水直到刻度线, ③写出“配制溶液的名称.浓度和日期 的标签.贴在备用的试剂瓶上. 答案:(1)配制前.未检查250 mL容量瓶是否漏液. (2)NaOH易潮解并具有腐蚀性.应放在干燥的烧杯中称量. (3)托盘天平不能准确称量“1.00g . (4)用过的天平的游码.未归原位. (5)NaOH溶于水放热.应静置冷却后.再将溶液移到容量瓶中. (6)溶液移入容量瓶后.烧杯和玻璃棒没有洗涤.残余碱液未全部移入容量瓶里. (7)定容后溶液没有充分摇匀. (8)NaOH对容量瓶有一定腐蚀作用.溶液定容后应及时转移到试剂瓶中.
网址:http://m.1010jiajiao.com/timu3_id_237968[举报]
将3.2g铜与过量浓硫酸共热反应,下列叙述中错误的是( )
| A、铜片溶解,生成物冷却后加水稀释溶液成蓝色 | B、生成的气体体积为1.12L | C、参加反应的硫酸与被还原的硫酸物质的量之比为2:1 | D、该实验中可用Na2CO3溶液处理尾气 |
实验室要配制1.84mol?L-1的稀硫酸500mL,回答下列问题:
(1)需要98%密度为1.84g?cm-3的浓硫酸
(2)配制时,必须使用的仪器有
①烧杯 ②50mL量筒 ③100mL量筒 ④1000mL容量瓶 ⑤500mL容量瓶⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是
(3)配制时,该实验两次用到玻璃棒,其作用分别是
(4)下列操作的顺序是(用字母表示)
A.冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①用量筒量取浓硫酸时,仰视读数
②转移后,没有洗涤烧杯和玻璃棒
③定容时,俯视读数
④定容时,添加蒸馏水超过刻度线后,吸出多余的溶液
查看习题详情和答案>>
(1)需要98%密度为1.84g?cm-3的浓硫酸
50
50
mL.(2)配制时,必须使用的仪器有
①②⑤⑦
①②⑤⑦
(填代号)①烧杯 ②50mL量筒 ③100mL量筒 ④1000mL容量瓶 ⑤500mL容量瓶⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是
胶头滴管
胶头滴管
.(3)配制时,该实验两次用到玻璃棒,其作用分别是
搅拌
搅拌
、引流
引流
.(4)下列操作的顺序是(用字母表示)
BEAGCGDF
BEAGCGDF
.A.冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有
BCD
BCD
(填序号).A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①用量筒量取浓硫酸时,仰视读数
偏高
偏高
;②转移后,没有洗涤烧杯和玻璃棒
偏低
偏低
;③定容时,俯视读数
偏高
偏高
;④定容时,添加蒸馏水超过刻度线后,吸出多余的溶液
偏低
偏低
.海洋植物如海带、海藻中含有丰富的碘元素.碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图:

(1)指出制取碘的过程中有关的实验操作名称:①
(2)提取碘的过程中.可供选择的有机试剂是
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液.实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是
(4)从含碘的有机溶液中提取碘和回收有机溶液.还需要经过蒸馏.观察右图实验装置指出其错误之处.
(5)已知常压下碘的升华温度137.2℃,四氯化碳沸点77℃.进行上述蒸馏操作时.使用水浴的原因是
查看习题详情和答案>>

(1)指出制取碘的过程中有关的实验操作名称:①
过滤
过滤
.②萃取、分液
萃取、分液
.(2)提取碘的过程中.可供选择的有机试剂是
B
B
.A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液.实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是
分液漏斗、锥形瓶
分液漏斗、锥形瓶
.
(4)从含碘的有机溶液中提取碘和回收有机溶液.还需要经过蒸馏.观察右图实验装置指出其错误之处.
缺石棉网;温度计插到了液体中;
缺石棉网;温度计插到了液体中;
;冷凝管进出水的方向颠倒;
冷凝管进出水的方向颠倒;
;(任意说两点即可)(5)已知常压下碘的升华温度137.2℃,四氯化碳沸点77℃.进行上述蒸馏操作时.使用水浴的原因是
受热比较均匀,温度容易控制
受热比较均匀,温度容易控制
.最后晶态碘在蒸馏烧瓶
蒸馏烧瓶
里聚集.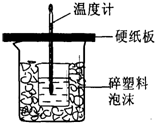 实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
环形玻璃搅拌棒
环形玻璃搅拌棒
;实验时用该仪器搅拌溶液的方法是上下搅动
上下搅动
,由图可知该装置有不妥之处,应如何改正?应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满
应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满
.(2)反应需要多次测量温度,每次测量温度后都必须采取的操作是
用水将温度计上的液体冲掉,并擦干温度计
用水将温度计上的液体冲掉,并擦干温度计
.(3)已知Q=cm△t,经数据处理,则该实验测得的中和热△H=
-56.8kJ/mol
-56.8kJ/mol
(盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g?℃)计算).
(4)盐酸与氢氧化钠的中和热的文献值为-57.3kJ/mol,你认为(3)中测得的实验值偏差可能的原因是
①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速
①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速
(至少说出两点)(5)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1
>
>
△H(填“<”、“>”或“=”),理由是NH3?H2O电离吸热
NH3?H2O电离吸热
. 某无色格液中只含有NH4+、K+ Al3+ Cu2+、Mg2+、CO32-、SO42-等离子中的几种,(1)取100mL该溶液,滴加足量稀硝酸酸化的Ba(NO3)2溶液,过滤得到0.03mol白色沉淀
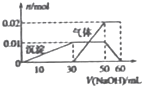
某无色格液中只含有NH4+、K+ Al3+ Cu2+、Mg2+、CO32-、SO42-等离子中的几种,(1)取100mL该溶液,滴加足量稀硝酸酸化的Ba(NO3)2溶液,过滤得到0.03mol白色沉淀(2)另取10mL该洛液于试管中,逐滴加人NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热).最后沉淀完全溶解.沉淀和气体的物质的量与所加NaOH溶液体积的变化关系如图所示( )
| A、溶液中一定不含有Cu2+、Mg2+、CO32-可能含有K+ | B、NH4+、Al3+、SO42-三种离子的物质的量之比为2:1:3 | C、实验中所用的NaOH溶液的物质的量浓度为0.1mol/L | D、只能通过焰色反应实验来确认该溶液中是否存在K+ |