摘要:28.某温度时.在2L的密闭容器中.X.Y.Z的物质的量 随时间的变化曲线如右图所示. (1)由图中所给数据进行分析.该反应的化学方程式为 , (2)反应从开始至2min末.用Z的浓度变化表示的反应速率为 v(Z)= . (3)若X.Y.Z均为气体.2min后反应达到平衡.平衡时体系的压强是开始时的 倍.
网址:http://m.1010jiajiao.com/timu3_id_237261[举报]
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)X的转化率是
30%
30%
(2)由图中所给数据进行分析,该反应的化学方程式为
3X+Y?2Z
3X+Y?2Z
;(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=
0.05mol/(l.min)
0.05mol/(l.min)
,(4)当反应进行到第
2
2
min,该反应是达到平衡状态
状态
.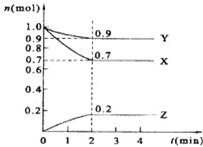 某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.(1)由图中所给数据进行分析,该反应的化学方程式为
3X+Y?2Z
3X+Y?2Z
;(2)反应从开始至2min末,用Z的浓度变化表示的反应速率为v(Z)=
0.05mol/(L.min)
0.05mol/(L.min)
.(3)若X、Y、Z均为气体,2min后反应达到平衡,平衡时体系的压强是开始时的
0.9
0.9
倍.
某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为 ;
(2)反应从开始至2min末,用Z的浓度变化表示的反应速率为v(Z)= .
(3)若X、Y、Z均为气体,2min后反应达到平衡,平衡时体系的压强是开始时的 倍.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)由图中所给数据进行分析,该反应的化学方程式为 ;
(2)反应从开始至2min末,用Z的浓度变化表示的反应速率为v(Z)= .
(3)若X、Y、Z均为气体,2min后反应达到平衡,平衡时体系的压强是开始时的 倍.
 查看习题详情和答案>>
查看习题详情和答案>>
某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为______;
(2)反应从开始至2min末,用Z的浓度变化表示的反应速率为v(Z)=______.
(3)若X、Y、Z均为气体,2min后反应达到平衡,平衡时体系的压强是开始时的______倍.

查看习题详情和答案>>
(1)由图中所给数据进行分析,该反应的化学方程式为______;
(2)反应从开始至2min末,用Z的浓度变化表示的反应速率为v(Z)=______.
(3)若X、Y、Z均为气体,2min后反应达到平衡,平衡时体系的压强是开始时的______倍.

 (1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为
(1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为3X+Y 2Z
2Z
 2Z
2Z3X+Y 2Z
2Z
; 2Z
2Z②反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=
0.05mol/(l.min)
0.05mol/(l.min)
,③当反应进行了3min,该反应是否达到平衡
是
是
(填“是”或“否”).(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中T1~T2速率变化的主要原因是
反应放热溶液温度升高反应速率增大
反应放热溶液温度升高反应速率增大
,T2~T3速率变化的主要原因是
溶液中H+的浓度逐渐减小反应速率减小
溶液中H+的浓度逐渐减小反应速率减小
.