题目内容
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)X的转化率是
30%
30%
(2)由图中所给数据进行分析,该反应的化学方程式为
3X+Y?2Z
3X+Y?2Z
;(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=
0.05mol/(l.min)
0.05mol/(l.min)
,(4)当反应进行到第
2
2
min,该反应是达到平衡状态
状态
.分析:(1)X的转化率等于X反应的物质的量与初始物质的量的比;
(2)根据图象知,X和Y的物质的量减小,则X和Y是反应物,Z是生成物,根据参加反应的物质的量之比等于其计量数之比写出反应方程式;
(3)根据反应速率公式计算;
(4)当反应达到平衡状态时,各物质的物质的量不变.
(2)根据图象知,X和Y的物质的量减小,则X和Y是反应物,Z是生成物,根据参加反应的物质的量之比等于其计量数之比写出反应方程式;
(3)根据反应速率公式计算;
(4)当反应达到平衡状态时,各物质的物质的量不变.
解答:解:(1)根据图象知,X的转化率=
×100%=30%,
故答案为:30%;
(2)根据图象知,X和Y的物质的量减小,则X和Y是反应物,Z是生成物,根据参加反应的物质的量之比等于其计量数之比写出反应方程式,X减少的物质的量=1.0mol-0.7mol=0.3mol,Y减少的物质的量=1.0mol-0.9mol=0.1mol,Z=0.2mol-0=0.2mol,则X、Y、Z的计量数之比为3:1:2,则该反应方程式为:
3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)Z的平均反应速率=
=0.05mol/(l.min),
故答案为:0.05mol/(l.min);
(4)根据图象知,当2min时各物质的物质的量不变,则该反应达到平衡状态,
故答案为:2,状态.
| (1.0-0.7)mol |
| 1.0mol |
故答案为:30%;
(2)根据图象知,X和Y的物质的量减小,则X和Y是反应物,Z是生成物,根据参加反应的物质的量之比等于其计量数之比写出反应方程式,X减少的物质的量=1.0mol-0.7mol=0.3mol,Y减少的物质的量=1.0mol-0.9mol=0.1mol,Z=0.2mol-0=0.2mol,则X、Y、Z的计量数之比为3:1:2,则该反应方程式为:
3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)Z的平均反应速率=
| ||
| 2min |
故答案为:0.05mol/(l.min);
(4)根据图象知,当2min时各物质的物质的量不变,则该反应达到平衡状态,
故答案为:2,状态.
点评:本题考查了反应速率的计算、化学反应方程式的确定、平衡状态的判断等知识点,难度不大,注意化学反应方程式中参加反应的物质的物质的量变化与计量数的关系.

练习册系列答案
相关题目
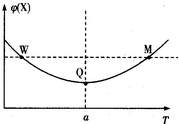 在某2L恒容密团容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是( )
在某2L恒容密团容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是( )| A、升高温度,平衡常数增大 | B、W点Y的正反应速率等于M点Y的正反应速率 | C、Q点时,Y的转化率最大 | D、平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大 |