网址:http://m.1010jiajiao.com/timu3_id_236583[举报]
为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1 mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?_______________________;理由是____________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:______________________________________。
查看习题详情和答案>>(1)若在滴加NaOH溶液的过程中,生成沉淀的质量m与加入NaOH溶液的体积关系如图所示。请回答:当V1=160mL时,则金属粉末中n(Mg)=_____mol,V2=______mL。
(2)若在滴加NaOH溶液的过程中欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液体积为________ml
(3)若混合物仍为0.1mol其中镁粉的物质的量的分数为a,用100ml2mol/L的硫酸溶解此混合物后再加入450ml1mol/L的氢氧化钠溶液,所得沉淀中无Al(OH)3。满足此条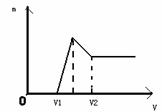 件a的取值范围是__ ___。
件a的取值范围是__ ___。
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:
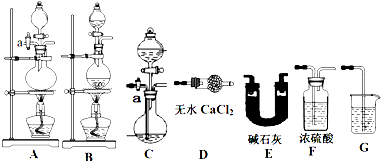
请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示)
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号)
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是
(5)步骤⑤的实验目的是
(6)该化肥样品中氮元素的质量分数为
(1)取1.56g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32g,样品中含硫化锌的质量分数是
(2)取1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70mL.通过计算确定浓硫酸被还原的产物是
(3)若将ZnS溶于强酸可产生硫化氢气体.在120°C、1atm下,将100mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70mL,求原混合气体中硫化氢的体积分数.(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48L SO2气体慢慢通入200mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g.通过计算确定所得晶体的成分与物质的量. 查看习题详情和答案>>