网址:http://m.1010jiajiao.com/timu3_id_235593[举报]
A.有两种活动性不同的金属(或非金属单质)作电极
B.电极材料均插入电解质溶液中
C.电极必须是金属
D.两极相连形成闭合电路
E.必须有一个自发的氧化还原反应
查看习题详情和答案>>|
对于原电池的组成条件,某同学列出了以下几点,其中正确的是 | |
A. |
有两种活动性不同的金属(或非金属单质)作电极 |
B. |
电极材料均插入电解质溶液中 |
C. |
电极必须是金属 |
D. |
两极相连形成闭合电路 |
E. |
必须有一个自发的氧化还原反应 |
(15分)氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。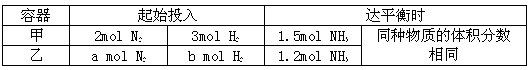
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 | D.形成1mol N N键的同时形成6molN—H键 |
(6)起始时,容器乙是容器甲压强的_____倍。 查看习题详情和答案>>
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
Ⅰ.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式______。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示) 。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。写出上述化学反应方程式:_____________________________________________________。
Ⅱ.在恒温条件下,起始时容积均为5 L的甲、乙两密闭容器中(甲为恒容容器、 乙为恒压容器),均进行反应:N2+3H2![]() 2NH3,有关数据及平衡状态特点见下表。
2NH3,有关数据及平衡状态特点见下表。
| 容器 | 起始投入 | 达平衡时 | ||
| 甲 | 2 mol N2 | 3 mol H2 | 1.5 mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 1.2 mo l NH3 | |
(4)下列能表明容器乙一定达平衡状态的是____________(填字母)
A.容器内的混合气体的平均相对分子质量不再变化
B.容器内的氮元素的质量不再变化
C.氢气的生成速率与氨气的消耗速率之比为2∶3
D.形成1 mol N≡N键的同时形成6 mol N—H键
(5)甲容器中氮气的转化率为 。
(6)起始时,容器乙是容器甲压强的_________倍。
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。
![]() II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。

(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
A.容器内的混合气体的平均相对分子质量不再变化
B.容器内的氮元素的质量不再变化
C.氢气的生成速率与氨气的消耗速率之比为2:3
![]() D.形成1mol N N键的同时形成6molN—H键
D.形成1mol N N键的同时形成6molN—H键
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。
查看习题详情和答案>>