摘要:(二) ,
网址:http://m.1010jiajiao.com/timu3_id_235418[举报]
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中
NO2、SO2
NO2、SO2
能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.如:CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
0.3
0.3
mol,放出的热量为| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4?2H2O).写出有关的化学反应方程式
SO2+Ca(OH)2=CaSO3↓+H2O、2CaSO3+O2+4H2O=2CaSO4?2H2O
SO2+Ca(OH)2=CaSO3↓+H2O、2CaSO3+O2+4H2O=2CaSO4?2H2O
.(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
| 催化剂 |
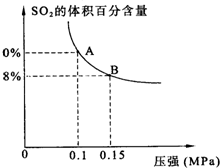
某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系
释放
释放
(填“吸收”或“释放”)能量.②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.该反应在该温度下的平衡常数等于
32
32
.二氧化碳碳捕获与封存技术(CCS)可以减少化石燃料燃烧以及其他工业用途的二氧化碳排放量,从而有助于减少温室气体的排放.该技术引起了各国的普遍重视.
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
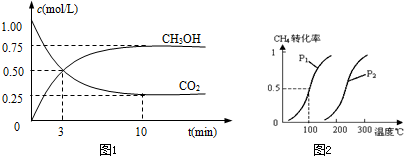
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
(2)反应①的△H1
,压强为P1,100℃时的平衡常数值是
查看习题详情和答案>>
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).②下列措施中能使n(CH3OH)/n(CO2)增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
增大
增大
(填“增大”、“减小”或“不变”),平衡向逆反应
逆反应
方向移动.(2)反应①的△H1
>
>
0(填“<”、“=”或“>”),其平衡常数表达式为K=| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
1.35×10-3
1.35×10-3
. 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是
B
B
(填序号).A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为
0.1
0.1
mol.(2)目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:
Cl--5e-+2H2O=ClO2↑+4H+
Cl--5e-+2H2O=ClO2↑+4H+
.②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为
0.01
0.01
mol;用平衡移动原理解释阴极区pH增大的原因在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大
在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大
.(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为
2ClO2+2CN-=N2↑+2CO2↑+2Cl-
2ClO2+2CN-=N2↑+2CO2↑+2Cl-
;处理100m3这种污水,至少需要ClO2| 50a |
| 13 |
| 50a |
| 13 |
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应:
(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g)△H3=-41.1kJ?mol-1
二甲醚合成反应:
(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一.工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是
Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3
Al2O3+3H2O
| ||
Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3
Al2O3+3H2O
(以化学方程式表示).
| ||
(2)分析二甲醚合成反应(Ⅳ)对于CO转化率的影响
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
.(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
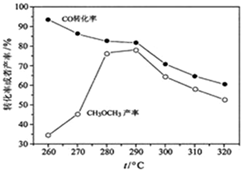
.(4)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是
反应放热,温度升高,平衡左移
反应放热,温度升高,平衡左移
.(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW?h?kg-1).若电解质为酸性,二甲醚直接燃料电池的负极反应为
CH3OCH3+3H2O=2CO2+12H++12e-
CH3OCH3+3H2O=2CO2+12H++12e-
,一个二甲醚分子经过电化学氧化,可以产生12
12
个电子的能量;该电池的理论输出电压为1.20V,能量密度E=1.2V×
| ||
|
1.2V×
| ||
|