摘要:某实验小组为探究和比较SO2和氯水的漂白性.设计了如下的实验装置. (1) 实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后.漏斗中液体未流下.你认为原因可能是: , (2) 实验室用装置E制备Cl2.其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O.若有6 mol的HCl参加反应.则转移的电子总数为 , (3)①反应开始一段时间后.观察到B.D两个试管中的品红溶液出现的现象是: B: .D: . ②停止通气后,再给B.D两个试管分别加热.两个试管中的现象分别为 B: .D: . (4)另一个实验小组的同学认为SO2和氯水都有漂白性.二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中.结果发现褪色效果并不像想象的那样.请你分析该现象的原因 . 六:附加题: 今有一混合物的澄清水溶液.只可能含有以下离子中的若干种:K+.NH4+ .Mg2+.Ba2+.Cl-.CO32 -.SO42 -.现取三份100 mL溶液进行如下实验: (1)第一份加入AgNO3溶液有沉淀产生 (2)第二份加足量NaOH溶液加热后.收集到气体0.04 mol (3)第三份加足量BaCl2溶液后.得干燥沉淀6.27 g.经足量盐酸洗涤.干燥后.沉淀质量为2.33 g.根据上述实验 一定存在的离子有 .可能存在的离子有 一定不存在的离子有 龙山中学2010~2011学年度第一学期期末考试
网址:http://m.1010jiajiao.com/timu3_id_234475[举报]
某实验小组为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
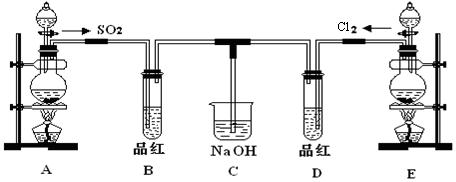
实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________;
实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为___________;
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为___________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:_________________________,D:________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_________________________,D:________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________________。
查看习题详情和答案>>某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
(2)实验室用装置E制备Cl2,其反应的离子方程式为:
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用离子方程式表示)
查看习题详情和答案>>

(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
分液漏斗的玻璃塞没有取下来
分液漏斗的玻璃塞没有取下来
;(2)实验室用装置E制备Cl2,其反应的离子方程式为:
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
.若有6mol的HCl参加反应,则转移的电子总数为
| ||
3×6.02×1023
3×6.02×1023
;(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:
品红褪色
品红褪色
,D:品红褪色
品红褪色
.②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
褪色的品红又恢复成红色
褪色的品红又恢复成红色
,D:无明显现象
无明显现象
.(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用离子方程式表示)
Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
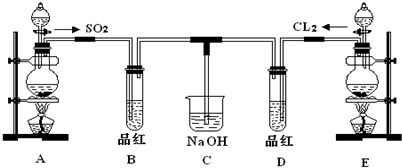
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:
(2)实验中NaOH溶液的作用是:
查看习题详情和答案>>

(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:
品红褪色
品红褪色
,D:品红褪色
品红褪色
.②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:
由无色变为红色
由无色变为红色
,D:无明显现象
无明显现象
.(2)实验中NaOH溶液的作用是:
吸收多余的二氧化硫和氯气,防止污染大气
吸收多余的二氧化硫和氯气,防止污染大气
.写出Cl2通入NaOH溶液中的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置.
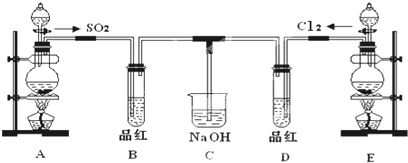
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ,D: .
②停止通气后,再给B、D两个试管分别加热, 试管中无明显现象.
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样.请你分析该现象的原因(用化学方程式表示) .
查看习题详情和答案>>

(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:
②停止通气后,再给B、D两个试管分别加热,
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样.请你分析该现象的原因(用化学方程式表示)
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
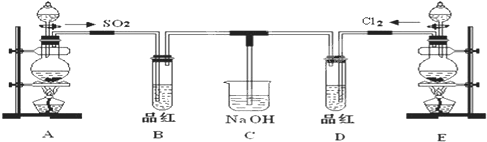
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是: .
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.若有6mol的HCl参加反应,则转移的电子总数为 .
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: .
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B: ,D: .
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示)提示SO2有较强的还原性. .
查看习题详情和答案>>

(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.若有6mol的HCl参加反应,则转移的电子总数为
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B:
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示)提示SO2有较强的还原性.