摘要:1 海洋化学资源
网址:http://m.1010jiajiao.com/timu3_id_23350[举报]
海洋化学资源的开发与综合利用将是二十一世纪重点发展的领域之一.以下是某化学学习小组在探究海水综合利用中遇到的问题,请你参与解决并填空:
问题一、海水制镁过程中如何富集镁离子?甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳;乙:高温加热蒸发海水后,加入石灰乳;
丙:向晒盐后的卤水中,加入石灰乳.
通过分析比较,你认为 的设想最为经济合理(选填“甲”、“乙”或“丙”).
问题二、粗盐纯化过程中如何除去可溶性杂质?
粗盐中含有硫酸钠、氯化钙、氯化镁等杂质.提纯时,先向粗盐水中加过量的 溶液,目的是完全除尽 (填离子符号);再加过量的 溶液,除去杂质阳离子;滤去沉淀,向滤液中加入适量的 ,将溶液的pH调为7,即得到精盐水.
问题三、海水“制碱”的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究:
【提出猜想】甲的猜想:样品中只含有碳酸钠;乙的猜想:样品中只含有氢氧化钠;
丙的猜想:样品中含有碳酸钠和氢氧化钠.
【实验、记录与分析】
步骤1中发生反应的化学方程式为: .
查看习题详情和答案>>
问题一、海水制镁过程中如何富集镁离子?甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳;乙:高温加热蒸发海水后,加入石灰乳;
丙:向晒盐后的卤水中,加入石灰乳.
通过分析比较,你认为
问题二、粗盐纯化过程中如何除去可溶性杂质?
粗盐中含有硫酸钠、氯化钙、氯化镁等杂质.提纯时,先向粗盐水中加过量的
问题三、海水“制碱”的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究:
【提出猜想】甲的猜想:样品中只含有碳酸钠;乙的猜想:样品中只含有氢氧化钠;
丙的猜想:样品中含有碳酸钠和氢氧化钠.
【实验、记录与分析】
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全溶解,再加入 |
乙的猜想不成立 | |
| 2 | 取步骤1反应后的溶液于试管中,向其中加入 |
溶液为无色 | 甲的猜想成立 |
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.Ⅰ.海水制溴.从海水中提取的溴约占世界溴产量的1/3,工业上常用“吹出法”制溴,其工艺流程如下: 试回答:
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 .
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(3)过程①中发生反应的化学方程式 ,该反应类型 .
(4)根据溶解度表分析过程②中能发生反应的原因是 ,过程②发生的化学方程式 该反应的类型为 .
(5)过程③中反应的化学方程式是 .
查看习题详情和答案>>
 试回答:
试回答:(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2
Br2+2KI=2KBr+I2,由此可判断C12、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠.便有品体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)过程①中发生反应的化学方程式
(4)根据溶解度表分析过程②中能发生反应的原因是
(5)过程③中反应的化学方程式是
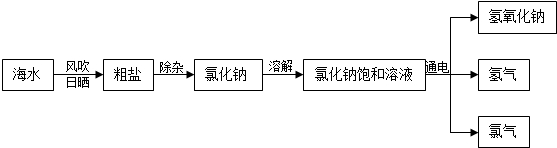
海洋是一个巨大的资源库,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的烧碱.其制取的主要工艺流程如下:
(1)利用风吹日晒可以从海水中提取粗盐,风吹日晒的主要作用是 .
(2)要除去食盐水中混有的少量泥沙,操作方法是 .
(3)写出电解氯化钠溶液的化学方程式 .
(4)该化工厂将副产品氢气和氯气加以利用:氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸.写出氢气在氯气中燃烧的化学方程式: ,通过这个化学反应,你对燃烧的新认识是 .
查看习题详情和答案>>

(1)利用风吹日晒可以从海水中提取粗盐,风吹日晒的主要作用是
(2)要除去食盐水中混有的少量泥沙,操作方法是
(3)写出电解氯化钠溶液的化学方程式
(4)该化工厂将副产品氢气和氯气加以利用:氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸.写出氢气在氯气中燃烧的化学方程式:
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.
I.海水提溴.从海水中提取的溴约占世界溴产量的
,工业上常用“吹出法”制溴,其工艺流程如下:
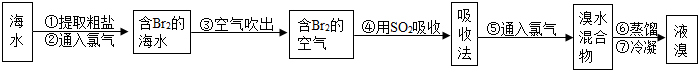
试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是 .
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是 .
(2)由上表分析过程②中能发生反应的原因是 .
(3)过程③中反应的化学方程式是 .
查看习题详情和答案>>
I.海水提溴.从海水中提取的溴约占世界溴产量的
| 1 |
| 3 |

试回答:
(1)步骤②中的化学方程式为2NaBr+Cl2=2NaCl+Br2,其反应类型是
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr2+I2
由此可判断Cl2、I2、Br2活动性由强到弱顺序是
Ⅱ.食盐制碱.我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水.
四种盐在不同温度下的溶解度表:
| 温度 溶解度/g 盐 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ------- | ------- |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | ------- |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)碳酸氢铵的化学式是
(2)由上表分析过程②中能发生反应的原因是
(3)过程③中反应的化学方程式是