摘要:海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图. 试完成下列问题: (1)粗盐中含有Ca2+.Mg2+.等杂质.精制后可得NaCl饱和溶液.精制时通常在溶液中依次加入过量的BaCl2溶液.过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性.请写出加入盐酸后可能发生的化学反应的离子方程式为 . (2)海水提取食盐后的母液中有K+.Na+.Mg2+等阳离子.从离子反应的角度思考.在母液里加入石灰乳起的作用是 . (3)海水里的镁元素处于游离态还是化合态? .从海水中提取氯化镁的反应是不是氧化还原反应? .用电解法冶炼金属镁的反应是不是氧化还原反应? .原因是 . (4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁.请思考镁蒸气可以在下列哪种气体氛围中冷却 . A.H2 B.CO2 C.空气 D.O2 解析:粗盐提纯的主要过程是:过量BaCl2(沉淀).过量NaOH(沉淀Mg2+).过量Na2CO3(沉淀Ca2+.Ba2+).适量HCl(中和Na2CO3并调节pH). 答案:(1)OH-+H+====H2O CO2-3+2H+====H2O+CO2↑ (2)将Mg2+沉淀为Mg(OH)2 (3)化合态 不是 是 发生了化合价的变化 (4)A
网址:http://m.1010jiajiao.com/timu3_id_233492[举报]
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.图是某工厂对海水资源的综合利用的示意图.
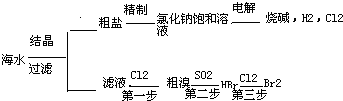
(1)粗盐中含Ca2+、Mg2+、SO
等杂质,精制时所用试剂为①盐酸;②BaCl2溶液;③NaOH溶液;④Na2CO3溶液.加入试剂顺序是
A.②③①④B.②③④①C.③②①④D.①④②③
(2)电解饱和食盐水时,与电源正极相连的电极上发生反应生成
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.在母液里加入的石灰乳起什么作用?
(4)写出从海水中提取Br2的第一步反应的离子方程式
(5)要使最终生成的Br2从水溶液中分离,常先加入
A.水 B.四氯化碳 C.酒精 D.过滤 E.分液.
查看习题详情和答案>>

(1)粗盐中含Ca2+、Mg2+、SO
2- 4 |
B
B
A.②③①④B.②③④①C.③②①④D.①④②③
(2)电解饱和食盐水时,与电源正极相连的电极上发生反应生成
氯气
氯气
气体,与电源负极相连的电极附近溶液pH变大
变大
(填“变大”、“不变”或“变小”).(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.在母液里加入的石灰乳起什么作用?
使镁离子生成氢氧化镁沉淀
使镁离子生成氢氧化镁沉淀
(4)写出从海水中提取Br2的第一步反应的离子方程式
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
,第二步反应的化学方程式Br2 +SO2 +2H2O=H2SO4 +2HBr
Br2 +SO2 +2H2O=H2SO4 +2HBr
.(5)要使最终生成的Br2从水溶液中分离,常先加入
B
B
,再E
E
.(选择下面选项填空)A.水 B.四氯化碳 C.酒精 D.过滤 E.分液.
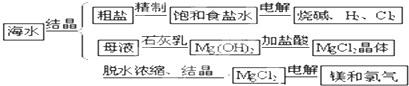
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性.请写出加入盐酸后发生反应的离子方程式 .
(2)海水里的镁元素处于 (游离、化合)态,从海水中提取氯化镁的反应 (“是”或“不是”)氧化还原反应,理由 .
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是 .
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却
A.H2 B.CO2 C.空气 D.O2.
查看习题详情和答案>>

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
2- 4 |
(2)海水里的镁元素处于
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却
A.H2 B.CO2 C.空气 D.O2.
海水中有取之不尽的化学资源,从海水中可提取多种化工原料。下图是某工厂对海水资源的综合利用的示意图。

试完成下列问题:
(1)粗盐中含有Ca2+、Mg2+、![]() 等杂质,精制后可得NaCl饱和溶液。精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式为______________________。
等杂质,精制后可得NaCl饱和溶液。精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式为______________________。
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起的作用是_________________________________________________________。
(3)海水里的镁元素处于游离态还是化合态?________________,从海水中提取氯化镁的反应是不是氧化还原反应?_______________,用电解法冶炼金属镁的反应是不是氧化还原反应?_______________,原因是______________________________________________。
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁。请思考镁蒸气可以在下列哪种气体氛围中冷却_______________。
A.H2 B.CO
