摘要:26. [知识回放]⑴H2SO4+2NaOH=Na2SO4+2H2O ⑵H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3 [挖掘实质]Ba2+和NO3-或Ba2+和2NO3-,2H++CO32-=H2O+CO2↑或2H++CO32-=H2CO3.H2CO3=H2O+CO2↑ (若未配平.生成物未标注箭头.不扣分) [实践运用]Ba2+和SO42-或Ba2+和CO32-或H+和CO32-,H+.Na+.K+和NO3- [知识升华] 溶液中的离子能否大量共存或者离子是否参加化学反应.参加化学反应的离子是否有剩余.(意义表达准确.都可给分.)
网址:http://m.1010jiajiao.com/timu3_id_23296[举报]
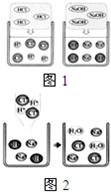 (2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
(2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
;(2)一个有沉淀生成的反应
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
.【挖掘实质】
(1)图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
Ba2+和NO3-
Ba2+和NO3-
(填离子符号).(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
.(3)通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH-不能大量共存;
H2SO4
H2SO4
溶液和Ba(NO3)2
Ba(NO3)2
溶液也可以发生复分解反应(任写一组物质,下同),因为Ba2+和SO42-在溶液中不能大量共存
Ba2+和SO42-在溶液中不能大量共存
;NaOH
NaOH
和K2CO3
K2CO3
溶液不能发生复分解反应,因为K+、CO32-、Na+和OH-
K+、CO32-、Na+和OH-
(填离子符号,下同)能大量共存.【知识升华】
通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是
复分解反应的实质是离子交换的反应,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生
复分解反应的实质是离子交换的反应,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生
.(2012?怀柔区二模)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
(2)一个有沉淀生成的反应
【挖掘实质】
(1)图1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
查看习题详情和答案>>
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
;(2)一个有沉淀生成的反应
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
.
【挖掘实质】
(1)图1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
Ba2+和NO3-
Ba2+和NO3-
(填离子符号).(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
.【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
Ba2+
Ba2+
和SO42-
SO42-
(填离子符号,下同)也不能大量共存.(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
H+、Na+、K+和NO3-
H+、Na+、K+和NO3-
.为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能含SO42- 可能含SO42- |
取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余.
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余.
.(2013?娄底)小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
【知识回放】
金属活动性顺序:K Ca Na Mg Al Zn
【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
[设计实验]
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
【结论与解释】
(1)小聪得到的结论是猜想
(2)实验前用砂纸打磨金属片的目的是
【知识运用】
将铬片投入FeSO4溶液中,反应
查看习题详情和答案>>
【知识回放】
金属活动性顺序:K Ca Na Mg Al Zn
Fe
Fe
Sn Pb(H)Cu
Cu
Hg Ag Pt Au,请你在横线上填写对应金属的元素符号.【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是
Fe>Cr>Cu
Fe>Cr>Cu
.【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
[设计实验]
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |
 |
 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 无明显现象发生(或无气泡生成,溶液也不变色) 无明显现象发生(或无气泡生成,溶液也不变色) |
(1)小聪得到的结论是猜想
1
1
正确.(2)实验前用砂纸打磨金属片的目的是
除去金属表面的氧化膜,利于反应
除去金属表面的氧化膜,利于反应
.【知识运用】
将铬片投入FeSO4溶液中,反应
能
能
(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式Cr+FeSO4=Fe+CrSO4
Cr+FeSO4=Fe+CrSO4
. 材料:2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭发射,首次实现月球软着陆和月面巡视勘察.12月15日晚,“嫦娥三号”着陆器和巡视器(玉兔月球车)成功分离,顺利互拍,任务取得圆满成功.长征三号运载火箭主要用于发射地球同步轨道有效载荷,它的一子级和二子级使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为推进剂,三子级则使用效能更高的液氢(H2)和液氧(O2).
材料:2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭发射,首次实现月球软着陆和月面巡视勘察.12月15日晚,“嫦娥三号”着陆器和巡视器(玉兔月球车)成功分离,顺利互拍,任务取得圆满成功.长征三号运载火箭主要用于发射地球同步轨道有效载荷,它的一子级和二子级使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为推进剂,三子级则使用效能更高的液氢(H2)和液氧(O2).(1)“长征三号”三子级火箭用液氢做燃料,其反应的化学方程式为
2H2+O2
2H2O
| ||
2H2+O2
2H2O
,使用液氢做燃料的优点有:
| ||
热值高
热值高
.(填一条)(2)下列有关偏二甲肼(C2H8N2)的叙述正确的是
BD
BD
A.由2个碳原子,4个氢原子,一个氮分子组成
B.由碳、氢、氮三种元素组成
C.由2个碳原子,8个氢原子,2个氮原子构成
D.组成元素碳、氢、氮的原子个数比为1:4:1
(3)“玉兔”月球车(如图)主体为长方形盒状,车底安有
六个轮状的移动装置,顶部两片太阳翼可以打开.腹部“武器”有避障相机、机械臂等.为“玉兔”
提供能源的有
太阳能
太阳能
电池、锂电池和核电池.“玉兔号”对“车轮”要求极高.月球车底盘和车轮由铝合金材料制成,这是由于铝合金具有
密度小
密度小
、机械强度高
机械强度高
的特性.机械臂末端配有坚硬的金刚石
金刚石
的钻头,可提取岩石内部样本.
(4)看见玉兔车金灿灿的车身后,小聪想到家里新换的水龙头.从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
【知识回放】
金属活动性顺序:K Ca Na
Mg
Mg
Al Zn Fe Sn Pb (H) CuHg
Hg
Ag Pt Au.请你在横线上填写对应金属的元素符号.【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是
Fe>Cr>Cu
Fe>Cr>Cu
.【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |
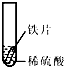 |
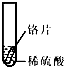 |
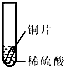 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜片表面不产生气泡 铜片表面不产生气泡 |
(1)小聪得到的结论是猜想
1
1
正确.(2)实验前用砂纸打磨金属片的目的是
除去金属表面的物质
除去金属表面的物质
.【知识运用】
将铬片投入FeSO4溶液中,反应
能
能
(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式Cr+FeSO4═CrSO4+Fe
Cr+FeSO4═CrSO4+Fe
.在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.

【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
(2)一个有沉淀生成的反应
【挖掘实质】
(1)图甲是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
(2)图乙是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
查看习题详情和答案>>

【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
;(2)一个有沉淀生成的反应
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
.【挖掘实质】
(1)图甲是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
Ba2+和NO3-
Ba2+和NO3-
(填离子符号).(2)图乙是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
.【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
Ba2+和SO42-或Ba2+和CO32-或H+和CO32-
Ba2+和SO42-或Ba2+和CO32-或H+和CO32-
(填离子符号,下同)也不能大量共存.(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
H+、Na+、K+和NO3-
H+、Na+、K+和NO3-
.为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- 可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- | ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. |
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余
.