网址:http://m.1010jiajiao.com/timu3_id_232858[举报]
单质铜及其化合物一般都具有特殊的颜色,如
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。
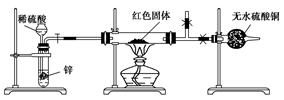
(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管 查看习题详情和答案>>
单质铜及其化合物一般都具有特殊的颜色,如
Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。

(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
查看习题详情和答案>>
单质A与氟以19的摩尔比在室温、高压(约为一兆帕)下混合、加热到900℃时有三种化合物B、C和D形成,其摩尔质量递增。它们都是熔点低于150℃的晶体。测得C中含氟量为36.7%(重量)、D中含氟量为46.5%(重量)。用无水氟磺酸在-75℃处理B时,形成化合物E和HF。E为晶体,在0℃时可稳定数周,但在室温只要几天就分解了。
1.通过计算或讨论,确定X的元素符号;
2.写出B、C、D的化学式和E的结构简式
3.根据价电子层电子互斥理论(VSEPR),B和C分子的几何构型各是什么?
4.使开始得到的B、C和D的混合物水解。B水解时放出A和O2,并且形成氟化氢水溶液。C水解时放出A和O2(摩尔比为43),并形成含有氧化物AO3和氟化氢的水溶液。D水解没有气体放出。写出三水解作用的反应方程式。
5.AO3具有强氧化性,可以将Mn2+氧化为KMnO4,写出离子反应方程式。
6.把B、C、D混合物完全水解以测定组成。用水处理一份混合物样品时,放出60.2mL气体(在290K和100kPa下测定的),这一气体中含有O2 40.0%(体积)。用0.100mol/L FeSO4水溶液滴定以测定水中AO3含量,共用36.0mL FeSO4溶液。计算原始B、C、D混合物的物质的量之比。
查看习题详情和答案>>| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。

(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管

请回答些列问题:
(1)写出甲的电子式是


(2)写出反应Ⅰ的化学方程式
| ||
| △ |
| ||
| △ |
(3)A溶于水得到得到溶液X,在25℃下,将a mol?L-1的X与b mol?L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图2装置处理污水.
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是