摘要:1.核外电子排布 要分清楚核外的填充式和核外电子的排布式.核外电子的排布式是根据主量子数和角量子数的大小确定的.主量子数即电子层数或周期数.角量子数即电子亚层.而电子填充式要考虑能级交错.所谓能级交错现象就是某些亚层电子钻穿能力很强.能钻穿到离核较近的区域.从第四周期开始.一些元素原子的电子就开始发生能级交错.如:Sc的核外电子排布式:1s22s22p63s23p63d14s2,Sc的核外电子填充式:1s22s22p63s23p64s23d1.
网址:http://m.1010jiajiao.com/timu3_id_232793[举报]
下列说法不正确的是
- A.原子核外的电子是分层排布的,从里向外分别为K、L、M、N……层
- B.核外电子排布要符合能量最低原理
- C.电子排布的规律之一是最外层不超过8个电子,所以第一层可以有7个电子
- D.每个电子层最多不能超过该层序数平方的2倍个电子
|
下列说法不正确的是 | |
A. |
原子核外的电子是分层排布的,从里向外分别为K、L、M、N……层 |
B. |
核外电子排布要符合能量最低原理 |
C. |
电子排布的规律之一是最外层不超过8个电子,所以第一层可以有7个电子 |
D. |
每个电子层最多不能超过该层序数平方的2倍个电子 |
A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增.A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6g D单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同.请回答下列问题:
(1)写出A、B、D的元素符号:A
(2)C离子的电子式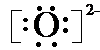
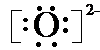 ;E的离子结构示意图
;E的离子结构示意图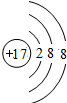
 .
.
(3)实验室里检验E的单质常用的试剂是
(4)写出电解D、E形成化合物的水溶液的化学反应方程式
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式
查看习题详情和答案>>
(1)写出A、B、D的元素符号:A
H
H
;BC
C
;DNa
Na
.(2)C离子的电子式
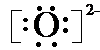
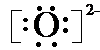


(3)实验室里检验E的单质常用的试剂是
淀粉KI溶液(或试纸)
淀粉KI溶液(或试纸)
.(4)写出电解D、E形成化合物的水溶液的化学反应方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式
HClO4+NaHCO3=NaClO4+H2O+CO2↑
HClO4+NaHCO3=NaClO4+H2O+CO2↑
.
按要求完成下列各题。
(1)单核10电子的微粒符号(至少写三种)______________________________,它们的核外电子排布_______________。
(2)双核10电子的微粒符号(至少写两种)____________________________________。
(3)三核10电子的微粒的结构式(写一种)____________________________________。
(4)四核10电子的微粒的电子式(写一种)____________________________________。
(5)五核10电子的微粒的结构式(写一种)____________________________________。
查看习题详情和答案>>
A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增.A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6g D单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同.请回答下列问题:
(1)写出A、B、D的元素符号:A______;B______;D______.
(2)C离子的电子式______;E的离子结构示意图______.
(3)实验室里检验E的单质常用的试剂是______.
(4)写出电解D、E形成化合物的水溶液的化学反应方程式______ 2NaOH+H2↑+Cl2↑ 查看习题详情和答案>>
(1)写出A、B、D的元素符号:A______;B______;D______.
(2)C离子的电子式______;E的离子结构示意图______.
(3)实验室里检验E的单质常用的试剂是______.
(4)写出电解D、E形成化合物的水溶液的化学反应方程式______ 2NaOH+H2↑+Cl2↑ 查看习题详情和答案>>