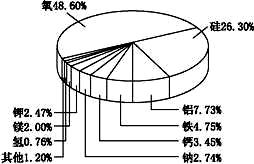
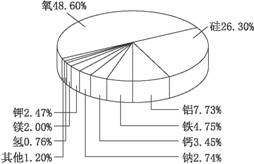
摘要:通过右图可以发现地壳中金属含量最多的是铝.其次是铁.而铜却根本没有上榜.而人类利用铜的历史却是最悠久的.请谈谈你的看法. 思路解析:金属的利用除了与含量多少的因素有关以外.还与金属的存在形态.开采.冶炼.煅造等技术有关.铜虽然含量不算高.但自然界有游离态的铜.人类最早利用的铜实际上就是陨石中的铜.加之铜的冶炼与开采技术也比较容易掌握.所以铜成了人类利用历史最为悠久的金属. 答案:自然界有游离态的铜.人类最早利用的铜实际上就是陨石中的铜.加之铜的冶炼与开采技术也比较容易掌握.所以铜成了人类利用历史最为悠久的金属.
网址:http://m.1010jiajiao.com/timu3_id_232655[举报]
 (2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
(2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度.
(1)甲同学的方案是否可行,说出理由:
不可行,Fe也会和盐酸反应
不可行,Fe也会和盐酸反应
.乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:

(2)配制5%的盐酸1L (ρ=1.025g/cm3 ),需取用36.5% (ρ=1.181g/cm3 )的盐酸
118.9
118.9
mL(保留一位小数).(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为
0.001
0.001
cm.丙同学的方案:通过右图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度.己称得镀锌铁皮质量为18.200g.
(4)实验所用称量仪器为
电子天平
电子天平
.(5)若改用浓盐酸,则测出锌的厚度会
偏小
偏小
(填“偏大”、“偏小”、或“无影响”).(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?
乙
乙
理由是:丙的方案中气体会带走水蒸气,易造成干扰
丙的方案中气体会带走水蒸气,易造成干扰
.氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ①??????????????????????????????? |
乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③??????????????????????????????? |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____??????????????????????????????????????? ,硬质玻璃管中氨发生催化氧化反应的化学方程式为????????????????????????? 。

(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?????????????????????? ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有???????????????????? 。
??? (4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。

查看习题详情和答案>>
 (2009?韶关一模)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
(2009?韶关一模)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:
在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
即可得溶液的pH
即可得溶液的pH
在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
即可得溶液的pH
.即可得溶液的pH
(2)简述强调“测得的pH小于7”的理由:
盐酸过量,这时溶液呈酸性,所以溶液的pH小于7
盐酸过量,这时溶液呈酸性,所以溶液的pH小于7
.方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是
赶走溶液中少量氧气,隔绝氧气
赶走溶液中少量氧气,隔绝氧气
.实验结果表明酚酞溶液红色消失与空气中的氧气无关.(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色.请用离子方程式解释这一现象产生的原因:
CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-由此说明酚酞溶液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:
做对比实验,取上述NaOH溶液稀释,加入酚酞溶液出现红色且不褪去
做对比实验,取上述NaOH溶液稀释,加入酚酞溶液出现红色且不褪去
.方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表).
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
7
7
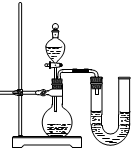
.(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验.则该同学根据
U形管中左边液面下降
U形管中左边液面下降
判断NaOH溶液与稀盐酸发生了中和反应.