网址:http://m.1010jiajiao.com/timu3_id_229623[举报]

实验结论.实验A、B、C所用试剂或所得结论列于下表中.
| 序 号 |
实验药品 | 实验结论 | ||
| 甲 | 乙 | 丙 | ||
| A | ① | 二氧化锰 | ② | 氧化性:O2>S |
| B | 醋酸溶液 | 碳酸钠溶液 | 硅酸钠溶液 | ③ |
| C | ④ | ⑤ | 氯化铝溶液 | 碱性:NaOH>NH3.H2O>Al(OH)3 |
(2)请填写①~⑤的试剂名称或实验结论:
①
(3)小明利用该装置自行设计了一个实验--证明NO2具有氧化性(注:丙中已事先添加Na2S溶液).据此回答下列问题:
①如何检验该装置的气密性:
②打开甲装置的活塞后,装置乙中发生反应的化学方程式为:
③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:
④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:
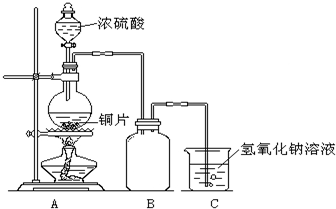
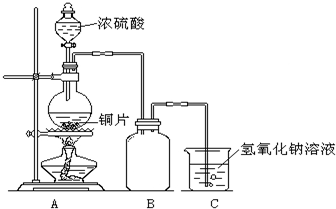 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:
| ||
| ||
实验中若有m g铜参加了反应,则有
| m |
| 64 |
| m |
| 64 |
| m |
| 32 |
| m |
| 32 |
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一
方案二
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)
| V |
| 22.4×0.012 |
| V |
| 22.4×0.012 |
请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:______,
实验中若有mg铜参加了反应,则有______mol硫酸被______(填“氧化”或“还原”),转移电子的物质的量为______mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是______(填写字母编号).
A.硫酸钠溶液B.氯化钡溶液C.银粉D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是______
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为VL(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一______;
方案二______.
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)______.
(1)将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为____________________。另取少许上层清液,先滴加适量的_________ (填化学式)酸化,再滴加_________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈__________性并具有__________性。
(2)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl====2Cl2↑+CaCl2+2H2O
该反应中,每生成1 mol Cl2,转移电子物质的量为__________,被氧化的HCl的物质的量为__________。
有效氯是漂粉精中有效成分Ca(ClO)2的含量大小标志,已知:有效氯
=![]() ×100%
×100%
若某漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数=___________。
(计算结果保留小数点后1位。已知相对分子质量用Mr表示:Mr(Cl2)=71,Mr[Ca(ClO)2]=143)
(3)现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂粉精,甲、乙、丙三人分别设计三个实验装置,如图1-3-1所示。已知Cl2与Ca(OH)2制漂粉精的反应是放热反应,而在较高温度下即发生如下反应:
6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O

图1-3-1
①请指出三个装置各自的缺点或错误(如没有可不填):
甲____________________________________________________________,
乙____________________________________________________________,
丙____________________________________________________________。
②图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置__________ (填所选部分的编号)。
③实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________ (假定各步反应均无反应损耗且无副反应发生)。
查看习题详情和答案>> 某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).(1)某学生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好.你认为该生的操作正确与否?
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚.改进该装置的方法是: