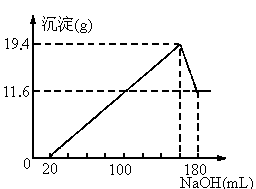
摘要:23.将一定质量的镁.铝合金投入100mL一定物质的量浓度的盐酸中.使合金全部溶解.向所得溶液中滴加5mol/L NaOH溶液至过量.生成沉淀的质量与加入的NaOH溶液体积的关系如右图曲线所示. 试求:(1)原合金中铝的质量分数. (2)盐酸的物质的量浓度. 江苏省启东中学2010~2011学年度第一学期期中考试
网址:http://m.1010jiajiao.com/timu3_id_227411[举报]
 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:(1)写出Al与NaOH溶液反应的离子方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)计算原合金中镁、铝的质量(请写出具体的计算过程,计算结果保留一位小数)
m(Mg)=4.8g,m(Al)=2.7g
m(Mg)=4.8g,m(Al)=2.7g
.(8分)将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解。向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如右图曲线所示。
试求:(1)原合金中铝的质量分数。
(2)盐酸的物质的量浓度。
查看习题详情和答案>>将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol· NaOH溶液到过量,生成沉淀的质量与加入的NaOH体积关系如下图,求:
NaOH溶液到过量,生成沉淀的质量与加入的NaOH体积关系如下图,求:

(1)原合金中Mg、Al质量各多少?
(2)HCl的浓度c(HCl)=?
查看习题详情和答案>>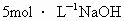 溶淀到过量,生成沉淀的质量与加入的NaOH体积关系如图,求:
溶淀到过量,生成沉淀的质量与加入的NaOH体积关系如图,求: